题目内容
【题目】下列各组微粒中,核外电子总数相等的是( )
A.Na+和Li+
B.CO和CO2
C.H2O和H3O+
D.NO和CO
【答案】C
【解析】A、Na+有10个电子,Li+有2个电子,A不符合题意;
B、碳原子有6个电子,氧原子有8个电子,CO核外电子总数是14,CO2核外电子总数是22,B不符合题意;
C、氢原子有1个电子,氧原子有8个电子,H2O核外电子总数是10,H3O+核外电子总数是10,C符合题意;
D、氮原子有7个电子,CO核外电子总数是14,NO核外电子总数是15,D不符合题意;
所以答案是:C

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
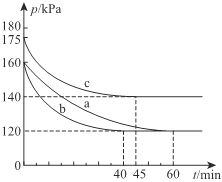
①与实验a相比,c组改变的实验条件可能是______________,判断的依据是______________________。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH=-42kJ·mol-1。
SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________,该温度下的平衡常数为______________。
②实验丙中,达到平衡时,NO2的转化率为_______________。
③由表中数据可推知,T1_____T2(填“>”“<”或“=”),判断的理由是____________________。
