题目内容
7.在标准状况下,2.24L HCl气体的质量为多少,将其溶于水,配成500mL盐酸溶液,所得溶液的H+的物质的量浓度?分析 根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算其质量,氢离子物质的量等于HCl的物质的量,根据c=$\frac{n}{V}$计算氢离子浓度.
解答 解:标准状况下,2.24L HCl的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,其质量为0.1mol×36.5g/mol=3.65g,n(H+)=n(HCl)=0.1mol,则c(H+)=$\frac{0.1mol}{0.5L}$=0.2mol/L,
答:在标准状况下,2.24L HCl气体的质量为3.65g,将其溶于水,配成500ml盐酸溶液,所得溶液的H+的物质的量浓度为0.2mol/L.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
17.胡椒粉是植物挥发油的成分之一.它的结构式为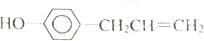 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
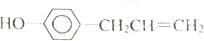 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )| A. | 1mol胡椒粉最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒粉最多可与4mol溴发生反应 | |
| C. | 胡椒粉能发生加聚反应,且能与氢氧化钠溶液反应 | |
| D. | 胡椒粉分子中所有碳原子可能在同一平面上 |
18.下列反应原理不符合工业冶炼金属事实情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4 $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ |
15.有机化合物A的相对分子质量大于110,小于150.经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧.则A的分子式为( )
| A. | C3H4O2 | B. | C4H10O5 | C. | C5H10O4 | D. | C5H8O5 |
2.食物是维持人类生命和健康的支柱.下表是某食品包装袋上的说明:
从该说明的配料中分别选出一种物质,填在相应的横线上:
富含蛋白质的是①鲜鸡蛋;富含油脂的是②植物油;
富含维生素的是③橙汁;富含蔗糖的是④白糖.
| 品名 | xxx蔬菜苏打饼 |
| 配料 | 小麦粉、鲜鸡蛋、精炼食用植物油、白糖、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2014年10月18日 |
富含蛋白质的是①鲜鸡蛋;富含油脂的是②植物油;
富含维生素的是③橙汁;富含蔗糖的是④白糖.
12.下列说法中,不正确的是( )
| A. | 任何化学反应中的能量变化都表现为热量变化 | |
| B. | 即使没有发生化学变化,也可能有能量的变化 | |
| C. | 化学反应中既有物质变化又有能量变化 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
19.下列离子方程式正确的是( )
| A. | 碳酸钙和盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸:Ba2++SO42-=BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑ | |
| D. | NaHCO3溶液与稀盐酸反应:H++HCO3-=CO2↑+H2O |
16.已知5KCl+KClO3+3H2SO4═3K2SO4+3Cl2+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4 既不是氧化剂又不是还原剂 | |
| D. | 1mol KCl参加反应时有5mol电子转移 |
11.下列物质一定是电解质的是( )
| A. | 氨 | B. | 液体时能导电的纯净物 | ||
| C. | 硫酸钡 | D. | 能导电的物质 |