题目内容
16.已知5KCl+KClO3+3H2SO4═3K2SO4+3Cl2+3H2O,下列说法不正确的是( )| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4 既不是氧化剂又不是还原剂 | |
| D. | 1mol KCl参加反应时有5mol电子转移 |
分析 5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,以此来解答.
解答 解:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.KCl为还原剂,被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故B正确;
C.硫酸中各元素的化合价不变,则H2SO4既不是氧化剂又不是还原剂,故C正确;
D.1molKCl参加反应时有1mol×1=1mol电子转移,故D错误;
故选D.
点评 本题考查氧化还原反应,明确反应中氯元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列与实验相关的叙述正确的是( )
| A. | Hg(NO3)2溶于水,可将含有Hg(NO3)2的废液倒入水池中,再用水冲入下水道 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,必须冷却至室温才能转移到容量瓶中 | |
| D. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
4.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)?2C(g)△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出关系图:
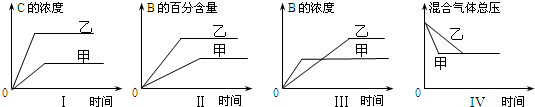
下列判断正确的是( )

下列判断正确的是( )
| A. | 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且乙的压强较高 | |
| C. | 图Ⅲ研究的是温度对反应的影响,且甲的温度较高 | |
| D. | 图IV 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
11.下列离子反应方程式正确的是( )
| A. | 钠和水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 铁与足量稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸氢钠溶液与烧碱溶液反应:NaHCO3+OH-═Na++CO32-+H2O |
1.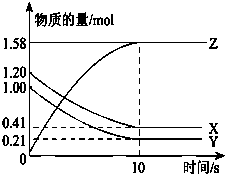 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 从0s到10s,用Z表示的反应速率为0.16 mol/(L•s) | |
| B. | 从0s到10s,X的物质的量浓度减少了0.80 mol/L | |
| C. | 从0s到10 s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)=Z(g) |
8.已知:某温度下,H2(g)+I2(g)?2HI(g)的平衡常数为K1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数为K2,则K1、K2的关系为( )
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | 不能确定 |
20.aA、bB、cC、dD、dE分别是五种短周期元素,它们的原子序数有如下关系:c-b=b-a=1,且b+c=d;常见化合物E2C2与水反应生成C的单质,且所得溶液能使酚酞溶液变红;B的最高价氧化物对应的水化物为强酸.下列说法正确的是( )
| A. | B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲 | |
| B. | 1mol E2C2与足量水完全反应生成C的单质,共转移2mol电子 | |
| C. | 原子半径:D>E>A>B>C | |
| D. | C的最简单氢化物的沸点比B的最简单氢化物的沸点低 |