题目内容
某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)他们决定用燃烧乙醇分析产物来确定乙醇中含有C、H两种元素。简要说明他们的具体操作:①证明含有氢元素的操作是________________________________________________________ _
________________________________________________________________________________________;
②证明含有碳元素的操作是________________________________________________
_______________________________________________________________________
(2)要用燃烧分析产物证实乙醇中还含有氧元素时,需取得一些实验数据,这些数据应该是________________________。
(3)为确定乙醇的分子式,除(2)中数据外,还需不需要测定乙醇的相对分子质量?
_______________________________________________________________________
(4)为测定乙醇分子结构,他们用了无水乙醇和金属钠反应收集生成氢气的方法,选用了如下图所示的仪器(有的仪器配用双孔橡皮塞)。
①装置的连接顺序是______接______接______接______接_______接_______。
②已知无水酒精的密度为0.789 g·cm一3,移取2.0mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为_______,由此可确定乙醇的结构为______________________而不是______________。
(5)实验所测定的结果偏高,可能引起的原因是(填写编号)。______________
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠反应不够完全
(1)①用一干燥的小烧杯倒置在乙醇燃烧的火焰的上方,烧杯内壁有水珠生成
②将内壁用澄清石灰水润湿的小烧杯倒置在火焰的上方,石灰水变浑浊
(2)乙醇、二氧化碳及水三种物质的质量 (3)不需要
(4)① D B E A F C ② 1;CH3CH2OH;CH3—O—CH3
(5)AB
解析试题分析:(1)①有机物中的H元素燃烧时生成H2O,所以用一干燥的小烧杯倒置在乙醇燃烧的火焰的上方,烧杯内壁有水珠生成可证明物质含氢元素。
②有机物中的C元素燃烧时生成CO2,所以将内壁用澄清石灰水润湿的小烧杯倒置在火焰的上方,石灰水变浑浊,可证明物质含碳元素。
(2)根据二氧化碳和水的质量。可求出C、H元素的质量,与乙醇的质量对比,即可判断出乙醇还含有碳元素。
(3)根据乙醇、二氧化碳及水三种物质的质量可求出C、H、O原子的个数比为:2:6:1,根据C、H、O的成键情况可知,乙醇的分子式只能为C2H6O,所以不需要测定乙醇的相对分子质量,即可确定乙醇的分子式。
(4)①分液漏斗与烧瓶相连为反应装置,气体通过E短导管进入A,A中的水沿F进入量筒,所以仪器的连接想、顺序为: D B E A F C
②乙醇的物质的量为:2.0mL×0.789g?cm-3÷46g/mol=0.034mol;生成的氢气为:0.39L÷22.4L/mol=0.017mol,所以 乙醇分子中能被钠取代出的氢原子数为1;可确定乙醇的结构为CH3CH2OH,而不是CH3—O—CH3
(5)A、本实验在室温下进行,气体摩尔体积大于22.4L/mol,造成结果偏高,正确;B、因为相同质量的甲醇反应生成的氢气更多,无水酒精中混有微量甲醇会造成结果偏高,正确;C、无水酒精与钠反应不够完全,生成的氢气偏少,则结果偏低,错误。
考点:本题考查化学实验的基本仪器连接和基本操作、实验方案的分析和误差分析、实验数据处理和计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):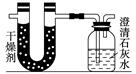
| | 实验前 | 实验后 |
| (干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
| (石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知: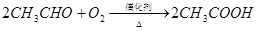
(1)反应II的化学方程式是 。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 。
(3)E是有香味的物质,在实验室用下图装置制取。
①反应IV的化学方程式是 ,该反应类型为 。
②该装置图中有一个明显的错误是 。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和 mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
下列过程前者属于物理变化,后者属于化学变化的是
| A.碳酸钠晶体的风化、硫酸铜检验水 |
| B.煤的干馏、石油的裂化 |
| C.碘的升华、熔融的氯化镁导电 |
| D.煤的气化、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
下列对应符号表述正确的是
| A.一氯甲烷的结构式CH3C1 | B.苯的分子式 |
| C.葡萄糖的结构简式C6H12O6 | D.丙烷分子的球棍模型 |
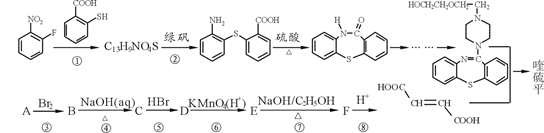
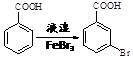 。写出以
。写出以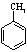 为原料制备
为原料制备 的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下: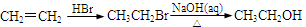 。
。


