题目内容
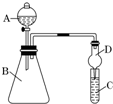
20. 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:(1)如图中,A管的作用是调节水面高度以控制反应的发生和停止,
制取乙炔的化学方程式是CaC2+2H2O=C2H2↑+Ca(OH)2.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是高锰酸钾溶液褪色,乙炔发生了氧化反应.
(3)为了安全,点燃乙炔前应检查乙炔的纯度,乙炔燃烧时的实验现象是火焰明亮伴有浓烈的黑烟.
分析 (1)通过调节A管液面可以控制右管中液面,从而控制反应的发生与停止;
(2)乙炔能含有不饱和键,能够被高锰酸钾氧化;
(3)可燃性气体在点燃前必须检验其纯度,以免发生爆炸;有机物含碳量越高,燃烧火焰越明亮,烟越浓.
解答 解:(1)有图可知:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,所以通过调节A管液面高度以控制反应的发生和停止;
故答案为:调节水面高度以控制反应的发生和停止;
(2)由于乙炔能含有不饱和键,能够被高锰酸钾氧化而使酸性高锰酸钾溶液褪色,乙炔发生氧化反应;
故答案为:高锰酸钾溶液褪色;氧化;
(3)乙炔为可燃性气体,在点燃前必须检验其纯度,以免发生爆炸;
乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,
故答案为:验纯; 火焰明亮伴有浓烈的黑烟.
点评 本题考查乙炔的实验室制法和性质的检验,熟悉乙炔的结构和化学性质是解题的关键,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
10.下列有关说法不正确的是( )
| A. | SO42-的空间构型是正四面体形 | |
| B. | CS2分子中各原子均达8电子稳定结构 | |
| C. | CH3-CH=CH2分子中碳原子的杂化类型有sp2和sp3两种 | |
| D. | H2O2分子是只含极性键的非极性分子 |
11. 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
8. 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
①c1合理的数值为D(填字母) A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
则曲线I、Ⅱ、Ⅲ对应的实验编号依次为③②①
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol•L-1 | 10.0 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)10-3mol•L-1 | 3.60 | c2 | 2.75 | 2.70 | 2.70 |
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验 序号 | T/℃ | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比表面积/㎡•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
15.一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为:X极:CH4+10OH--8e-=CO32-+7H2O;
Y极:4H2O+2O2+8e-=8OH-.
下列关于此燃料电池的说法中,错误的是( )
Y极:4H2O+2O2+8e-=8OH-.
下列关于此燃料电池的说法中,错误的是( )
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
12.下列实验方案合理的是( )
| A. | 鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 | |
| B. | 检验酒精中的少量水:向酒精中加入足量生石灰 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如右图所示的实验装置 |
9.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.