题目内容
【题目】某学习小组欲测定市售橙汁饮料中维生素C的含量。每100克鲜榨橙汁中含有大约37.5毫克的维生素C。实验室可用碘量法测定橙汁饮料中维生素C的含量,反应的方程式为C6H8O6+I2==C6H6O6+2HI(维生素C化学式为C6H8O6,相对分子质量为176),其实验步骤及相关数据如下:
①标准溶液的稀释:移取浓度为0.0080mol/L的碘标准溶液25.00mL于250mL容量瓶中,定容,摇匀备用。
②移取10.00mL饮料样品(设密度为1.0g/cm3)于250 mL锥形瓶中,加入50mL蒸馏水,2mL指示剂。
③在滴定管中装入稀释后的标准溶液,滴定至终点,读取并记录相关数据。
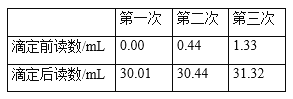
④重复测定3次,数据记录如下表。
回答下列问题:
(1)实验中盛装标准溶液应选择______(填“酸式”或“碱式”)滴定管。
(2)步骤2中加入的指示剂是___________,判断滴定达到终点的现象是__________。
(3)实验中下列操作可能导致测定结果偏低的是_______(填标号)。
A.稀释标准溶液定容时俯视刻度线
B.滴定结束时俯视读
C.在锥形瓶中加入样品后放置较长时间才开始滴定
D.滴定管尖嘴部分有气泡,滴定后消失
(4)计算该饮料样品中维生素C含量为________mg/100 g。该含量______(填“高于”或“低于”)鲜榨橙汁。
【答案】酸式 淀粉溶液 溶液变为蓝色,且半分钟不褪色 ABC 42.2 高于
【解析】
⑴单质碘易腐蚀橡皮管。
⑵用单质碘滴定,得出加入的指示剂。
⑶A. 稀释标准溶液定容时俯视刻度线,溶液体积偏小,标液浓度偏大,所消耗标液体积减少,浓度偏低;B. 滴定结束时俯视读数,溶液体积偏小,测定结果偏低;C. 在锥形瓶中加入样品后放置较长时间才开始滴定,部分被被氧化,所消耗标液体积减少,测定结果偏低;D. 滴定管尖嘴部分有气泡,滴定后消失,得到消耗标液体积偏大,测定结果偏高。
⑷得出三次数据的平均值和碘标准溶液浓度,根据方程式得到10mL饮料中C6H8O6的物质的量,再得100g饮料样品中维生素C含量的质量。
⑴单质碘易腐蚀橡皮管,因此实验中盛装标准溶液应选择酸式滴定管;故答案为:酸式。
⑵用单质碘滴定,因此步骤2中加入的指示剂是淀粉溶液,判断滴定达到终点的现象是溶液变为蓝色,且半分钟不褪色;故答案为:溶液变为蓝色,且半分钟不褪色。
⑶A. 稀释标准溶液定容时俯视刻度线,溶液体积偏小,标液浓度偏大,所消耗标液体积减少,浓度偏低,故A符合题意;
B. 滴定结束时俯视读数,溶液体积偏小,测定结果偏低,故B符合题意;
C. 在锥形瓶中加入样品后放置较长时间才开始滴定,部分被被氧化,所消耗标液体积减少,测定结果偏低,故C符合题意;
D. 滴定管尖嘴部分有气泡,滴定后消失,得到消耗标液体积偏大,测定结果偏高,故D不符合题意。
综上所述,答案为ABC。
⑷三次数据的平均值为30.00mL,移取浓度为0.0080 molL1的碘标准溶液25.00 mL于250 mL容量瓶中,定容,摇匀备用,碘标准溶液浓度为0.0008 molL1,根据C6H8O6+I2 = C6H6O6+2HI得到10mL饮料即10g中C6H8O6的物质的量n(C6H8O6)= 0.0008 molL1×0.03L = 2.4×105 mol,则100g饮料样品中维生素C含量为2.4×105 mol ×10×176×103mg![]() mol1= 42.2mg,即该饮料样品中维生素C含量为42.2mg/100g该含量高于鲜榨橙汁;故答案为:42.2;高于。
mol1= 42.2mg,即该饮料样品中维生素C含量为42.2mg/100g该含量高于鲜榨橙汁;故答案为:42.2;高于。

【题目】在试管中进行下列实验,现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向硫酸铜水溶液中逐滴加入氨水 | 先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液 |
B | 向I2的CCl4溶液中加入浓KI溶液,振荡 | 溶液紫红色变浅 |
C | 向橙色的K2Cr2O7溶液中加入10滴浓硫酸,振荡 | 溶液由橙色变为黄色 |
D | 向饱和硼酸溶液中加入Na2CO3溶液 | 无明显现象 |
A.AB.BC.CD.D