题目内容
下列图示与对应的叙述相符的是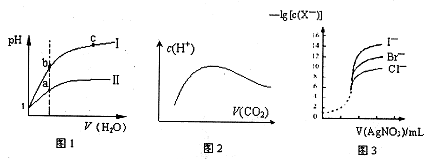
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
B
解析试题分析:A项中,图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释,pH的变化快的曲线是强酸,故曲线I为盐酸,说法错误;B项中,因为酸碱抑制水电离,盐的水解促进水电离,起始的NaOH溶液,水电离的c(H+)小,与CO2反应生成Na2CO3时水解,水电离的c(H+)最大,最后成为饱和的碳酸溶液,水电离出的c(H+)又减小,故图2正确;C项中,图2所示,水电离出c(H+)达到最大值是生成Na2CO3时,溶液中各离子浓度大小分应为c(Na+)>c(CO32-)>c(OH-) >c(HCO3-)>c(H+),故不正确;D项在,用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线可知c(I-)最小,可确定首先沉淀的是I-,说法错误。
考点:溶液中的四大平衡的图像诠释。

练习册系列答案
相关题目
常温下,下列各溶液中微粒的物质的量浓度关系正确的是
| A.将pH=6的H2SO4稀释1000倍后,c(H+)=" 2" c(SO42—) |
| B.0.1 mol L-1的 Na2CO3溶液中:c(OH— ) = c(HCO3— ) + c(H+) + c(H2CO3) |
| C.浓度均为0.1 mol L-1 '的 NaClO 溶液和 CH3COONa 溶液中,c(ClO—)﹤c(CH3COO—) |
| D.浓度分别为0.1 mol L-1和0.01 mol L-1的CH3COOH溶液中:c(CH3COO—)前者是后者的10倍 |
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是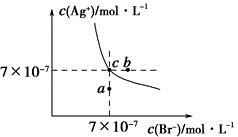
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
氨水中存在下列的电离平衡:NH3·H2O NH
NH +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
| A.NaOH固体 | B.NH4Cl固体 |
| C.H2SO4 | D.H2O |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH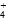 ]∶[SO ]∶[SO ] ] |
| B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比 |
C.Na2CO3溶液中,[Na+]∶[CO ] ] |
| D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH) |
Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s) Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
| A.加入MgCl2溶液 | B.加入少量NaOH |
| C.加入NH4NO3溶液 | D.加入K2S溶液 |
溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |