题目内容
【题目】小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
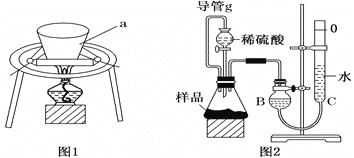
Ⅰ、加热分解法
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为___________________。
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量W1g;
②加热前,仪器a和样品的总质量W2g;
③加热冷却后,仪器a和残留物的总质量W3g。
(3)列出小苏打样品中NaHCO3的质量分数的计算式____________________
Ⅱ、测量气体体积法
利用图2装置,测定反应生成气体的体积。
(1)组装好仪器后,首先进行的操作为_________________________________________。
(2)导管g的作用为_________________________________________________________。
(3)为了减小实验误差,B、C中最好用________________溶液代替水。
(4)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①读数时应上下移动C管,使B、C两管液面相平;
②视线与液面最低处相平。
(5)若所取样品的质量为m g,反应前滴定管C的读数为V1 mL,反应结束后滴定管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为_______________(气体体积均已换算为标准状况下的体积)。
【答案】坩埚84(W2-W3)/31(W2-W1)检查装置气密性平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差饱和NaHCO3(V1-V2)/22400mol
【解析】
Ⅰ(1)根据仪器的形状和用途分析其名称。
(3)样品中碳酸氢钠固体受热发生分解,利用质量差量法进行计算出样品中纯碳酸氢钠固体的质量,然后计算样品中碳酸氢钠的质量分数。
Ⅱ(1)有气体生成的反应,实验过程中尽量避免气体的损失,要检查装置的气密性。
(2)g有平衡气压、使液体顺利流下,减少误差的作用。
(3)二氧化碳易溶于水,但难溶于饱和碳酸氢钠溶液。
(5)根据信息计算出反应产生二氧化碳气体的总量,然后根据C原子守恒计算NaHCO3和Na2CO3的物质的量之和。
Ⅰ(1)这是一个用来给固体加热的陶瓷仪器,该仪器名称是坩埚;正确答案:坩埚。
(3)设样品中含有纯碳酸氢钠为xg;根据题意分析可知:样品质量为(W2-W1)g,根据反应进行计算:
2NaHCO3 = Na2CO3+ CO2↑+ H2O 质量减少量
2×84 106 m=62
x (W2-W1)-((W3-W1)
列方程求出x=168(W2-W3)/62=84(W2-W3)/31 ;小苏打样品中NaHCO3的质量分数的计算式=[84(W2-W3)]/[31×(W2-W1)]=84(W2-W3)/31(W2-W1);正确答案:84(W2-W3)/31(W2-W1)。
Ⅱ(1)连接仪器后在实验前要检查装置气密性,否则可能导致实验失败;正确答案:检查装置气密性。
(2)①导管g的作用是:平衡分液漏斗与锥形瓶内的气压,使液体顺利流下,否则稀硫酸不易流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的体积误差,而使测量更准确;正确答案:平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差。
(3)二氧化碳能溶于水,但难溶于饱和碳酸氢钠溶液,从而减少误差,所以可以用饱和碳酸氢钠代替水;正确答案:饱和NaHCO3。
(5)CO2气体体积=(V1-V2)mL,则n(CO2)=(V1-V2)×10-3/22.4mol;根据C原子守恒得:n(NaHCO3)+n(Na2CO3)=n(CO2)= (V1-V2)×10-3/22.4=(V1-V2)/22400mol;正确答案:(V1-V2)/22400mol。