题目内容
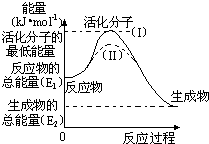
(8分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能 ,因此反应速率 ,你认为最可能的原因是: 。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:___________ _________
(1)放热; 需要; E2 - E1 (2)降低;加快;使用了催化剂
(3)N2(g)+3H2(g)
 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
【解析】(1)根据图像可判断,反应物的总能量高于生成物的总能量,是放热反应。反应物要先转化为活化分子,所以需要提供能量。反应热就是生成物的总能量和反应物的总能量的差值,因此△H=E2 - E1。
(2)根据图像可知虚线表示的活化能小,所以反应速率加快。能降低活化能的是催化剂。
(3)反应热是断键吸收的能量和形成化学键所放出的能量的差值,所以生成2mol氨气的反应热是946kJ/mol+3×436kJ/mol-2×3×391kJ/mol=-92kJ/mol,所以热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1。
2NH3(g) ΔH=-92kJ·mol-1。

 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.