题目内容
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或 三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁 +辛,甲+ 丙=戊+辛;常温下0.1 mol/L 丁溶液的pH为13。下列说法正确的是
A.元素B在周期表中的位置为第二周期第VIA族
B.元素B、C、D的原子半径由大到小的顺序为r (D) > r(C) > r(B)
C.1.0 L0. 1 mol/L戊溶液中阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02 X 1023个电子
D
解析试题分析:首先要找突破口推断A、B、C、D四种元素的名称,突破口之一是“0.1 mol?L-1丁溶液的pH为13(25℃).”丁是一元强碱且其中的金属元素在短周期,推断出丁中金属元素为钠。突破口之二是“甲+乙=丁+辛,甲+丙=戊+辛”; “丁”是氢氧化钠,那么甲是Na2O2、乙是水,丙是二氧化碳,戊是碳酸钠,因此A为氢、B为碳、C为氧、D为钠元素。
A选项, B为碳,在周期表中的位置为:第二周期第ⅣA族,错误;B选项,由以上分析可知:A为氢、B为碳、C为氧、D为钠元素,则原子半径大小顺序为:Na>C>O>H,r (D) > r(B) > r(C),错误;C选项,戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,错误;D选项,甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,正确。
考点:本试题重点考查元素周期表和元素周期律相关知识。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案短周期元素W、X、Y和Z的原子序数依次增大。其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3。根据以上叙述,下列说法中正确的是
| A.以上四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法正确的是( )
| A.电子云就是电子运动的形态 |
| B.焰色反应产生的是发射光谱 |
| C.铜原子处于基态时的核外电子排布式为3d104s1 |
| D.核外电子运动状态可以用牛顿运动定律来描述,也可以用统计方法来描述 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.最高价氧化物对应水化物的碱性A>C B.氢化物的沸点H2D < H2E
C.单质与稀盐酸反应的速率A<B D.C2+与A+的核外电子数相等
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是
| A.X元素气态氢化物的水溶液呈酸性 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
依据元素周期表及元素周期律,下列推断正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |
可能存在的第119号未知元素,有人称为“类钫”,根据元素周期表结构及性质变化趋势,判断有关“类钫”的预测正确的是
| A.具有放射性 | B.单质有较高的熔点 |
| C.在化合物中呈+2价 | D.单质的密度小于1 g/cm3 |
如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是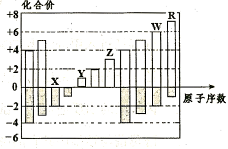
| A.原子半径:R>W>Z>Y>X |
| B.R的气态氢化物比W的气态氢化物稳定 |
| C.X与Y可形成既含离子键又含共价键的化合物 |
| D.Y的最高价氧化物对应水化物与Z的最高价氧化物 |
下图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是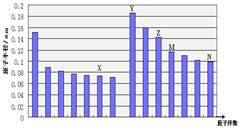
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |