题目内容
如图为元素周期表短周期的一部分.E原子的电子层数为n,最外层电子数为2n+1下列叙述不正确的是
( )
| A | B | C | |
| D | E |
| A、C和E氢化物的热稳定性和还原性均依次减弱 |
| B、A与B形成的阴离子可能有AB32-、A2B42- |
| C、AD2分子中每个原子的最外层均为8电子结构 |
| D、A、D、E的最高价氧化物对应的水化物的酸性依次增强 |
分析:由元素在周期表中的位置可知,A、B、C位于第二周期,D、E位于第三周期,E原子的电子层数为n,则n=3,其最外层电子数为2n+1,故E原子最外层电子数为7,则E为Cl;可推知A为碳元素、B为O、C为F、D为S,据此解答.
解答:解:由元素在周期表中的位置可知,A、B、C位于第二周期,D、E位于第三周期,E原子的电子层数为n,则n=3,其最外层电子数为2n+1,故E原子最外层电子数为7,则E为Cl;可推知A为碳元素、B为O、C为F、D为S,则:
A.非金属性F>Cl,故稳定性HF>HCl,还原性HF<HCl,故A错误;
B.C与O形成的阴离子可能有CO32-、C2O42-,故B正确;
C.CS2分子中|C、S原子化合价|+最外层电子数都等于8,每个原子的最外层均为8电子结构,故C正确;
D.非金属性C<S<Cl,故酸性:碳酸<硫酸<高氯酸,故D正确,
故选A.
A.非金属性F>Cl,故稳定性HF>HCl,还原性HF<HCl,故A错误;
B.C与O形成的阴离子可能有CO32-、C2O42-,故B正确;
C.CS2分子中|C、S原子化合价|+最外层电子数都等于8,每个原子的最外层均为8电子结构,故C正确;
D.非金属性C<S<Cl,故酸性:碳酸<硫酸<高氯酸,故D正确,
故选A.
点评:考查结构位置性质关系、元素周期表与元素周期律等,比较基础,注意整体把握元素周期表的结构与元素周期律.

练习册系列答案
相关题目
 四种短周期元素在元素周期表中的位置如图所示,同周期中Z的原子半径最小.下列说法正确的是( )
四种短周期元素在元素周期表中的位置如图所示,同周期中Z的原子半径最小.下列说法正确的是( )| A、M元素一定为金属元素 | B、X元素的最简单气态氢化物的热稳定性比Z元素的大 | C、Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 | D、Z元素与氢元素一定能形成原子个数比为1:1的共价化合物 |




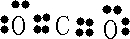
 H++Cl-+HClO
H++Cl-+HClO
