题目内容
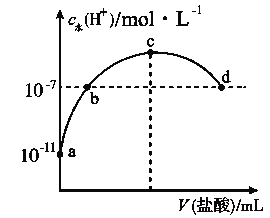
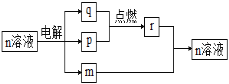
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。m、n、r为这些元素组成的化合物,常温下,0.1 mol·L-1 m溶液的pH=13,组成n的两种离子的电子层数相差1。p、q为其中两种元素形成的单质。上述物质的转化关系如图所示。下列说法正确的是 ( )
A. 原子半径:X<Y<Z<W
B. X、Z既不同周期也不同主族
C. 简单氢化物的沸点:Y<W
D. Y、Z、W形成的一种化合物具有漂白性
【答案】D
【解析】
0.1mol·L-1m溶液的pH=13,则m为一元强碱,应该为NaOH,组成n的两种离子的电子层数相差1,根据图示可知,n为NaCl,电解NaCl溶液得到NaOH、H2和Cl2,p、q为其中两种元素形成的单质,则p、q为H2和Cl2,结合短周期主族元素X、Y、Z、W的原子序数依次增大可知:X为H元素、Y为O元素、Z为Na元素、W为Cl元素,据此答题。
由分析可知:X为H元素、Y为O元素、Z为Na元素、W为Cl元素。
A.电子层数越多,则原子的半径越大,具有相同电子层数的原子,随着原子序数的递增,原子半径逐渐减小,所以原子半径:X<Y<W<Z,故A错误;
B.由分析可知:X为H元素、Z为Na元素,X、Z的最外层电子数均为1,属于同一主族,故B错误;
C.Y、W形成的氢化物分别为H2O和HCl,因为水分子中含有氢键,含有氢键的物质熔沸点较高,所以简单氢化物的沸点:Y>W,故C错误;
D.Y、Z、W形成的一种化合物为NaClO,NaClO具有强氧化性,可用于漂白,具有漂白性,故D正确。
故选D。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是


实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D