题目内容
已知:CH3Cl常温下为气态,难溶于水,易溶于乙醇等有机溶剂,实验室制备CH3Cl原理为:CH3OH+HCl(浓) 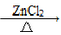 CH3Cl(g)+H2O
CH3Cl(g)+H2O
(1)实验步骤如下:
①干燥ZnCl2晶体。实验室干燥ZnCl2晶体制得无水ZnCl2的方法是____。
②称取13.6g研细的无水ZnCl2,量取20mL浓盐酸、一定量的CH3OH,分别放入装置______(填装置编号)的对应仪器中;

③产生的CH3Cl气体,最好选用排水法收集,原因是___________。
(2)为探究CH3Cl与CH4分子稳定性的差别,某化学兴趣小组设计实验验证CH3Cl能被强氧化剂酸性高锰酸钾溶液氧化。
①将CH3Cl制备装置中产生的气体依次通过以下三个洗气瓶______(按顺序填洗气瓶编号),如果观察到A中紫色褪去的实验现象则证明CH3Cl稳定性弱于CH4。
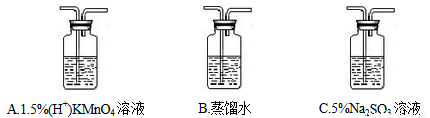
②实验过程中发现,洗气瓶A中紫色褪去了,并产生一种黄绿色气体和一种无色气体,则其发生反应的离子方程式:_________; 洗气瓶C中发生反应的离子方程式:____________。
③为处理未反应完的CH3Cl,还应在上述洗气瓶后接一只盛_________(填试剂名称)的洗气瓶。
练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目


 Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O )中毒反应,可静脉注滴NaHCO3溶液:
)中毒反应,可静脉注滴NaHCO3溶液: +2CO2↑+2H2O
+2CO2↑+2H2O