题目内容
18.已知在25℃,101KPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40KJ热量.表示上述反应的热化学方程式正确的是( )| A. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(g)△H=-48.40KJ/mol | |
| B. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-5518KJ/mol | |
| C. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=+5518KJ/mol | |
| D. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-48.40KJ/mol |
分析 在25℃时,101kPa下,1g辛烷燃烧生成二氧化碳和液态水放出48.40KJ的热量,则1mol辛烷即114g辛烷燃烧生成二氧化碳和液态水放出5518KJ的热量,根据反应物和生成物的状态及反应热写出其热化学反应方程式.
解答 解:在25℃时,101kPa下,1g辛烷燃烧生成二氧化碳和液态水放出48.40KJ的热量,则1mol辛烷即114g辛烷燃烧生成二氧化碳和液态水放出5518KJ的热量,所以其热化学反应方程式为:C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol,
故选B.
点评 本题考查了热化学反应方程式的书写,注意物质的聚集状态和对应化学方程式计量数的反应焓变计算,题目较简单.

练习册系列答案
相关题目
9.为了证明甲酸溶液中含有甲醛,正确的操作是( )
| A. | 滴入石蕊试液 | |
| B. | 加入金属钠 | |
| C. | 加入银氨溶液(微热) | |
| D. | 加入氢氧化钠溶液后加热蒸馏,在馏出物中加入银氨溶液(微热) |
6.已知两瓶气体分别是HCl 和Cl2,可以区别它们的方法或试剂是( )
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸⑤湿润的蓝色石蕊试纸 ⑥AgNO3溶液.
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸⑤湿润的蓝色石蕊试纸 ⑥AgNO3溶液.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
13.在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应化学平衡常数的表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的密度不变 D.c(CO)=c(CO2)
E.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)为了提高H2的转化率,下列措施可行的是D
A.降低温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充CO2
(5)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为830℃.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应化学平衡常数的表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的密度不变 D.c(CO)=c(CO2)
E.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)为了提高H2的转化率,下列措施可行的是D
A.降低温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充CO2
(5)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为830℃.
3.已知链式炔碳C300经过适当处理可得含多个-C≡C-(不含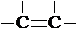 )的链状化合物C300H298,则含-C≡C-的个数为( )
)的链状化合物C300H298,则含-C≡C-的个数为( )
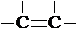 )的链状化合物C300H298,则含-C≡C-的个数为( )
)的链状化合物C300H298,则含-C≡C-的个数为( )| A. | 70 | B. | 72 | C. | 74 | D. | 76 |
10.地壳中含量占第1、2位的元素间形成的化合物,不具有的性质是( )
| A. | 常温下与水反应生成酸 | B. | 高温时能与纯碱反应 | ||
| C. | 熔点高,硬度大 | D. | 常温下能与NaOH溶液反应 |
8.下列过程与加成反应有关的是( )
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙烯与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在一定条件下生成四氯化碳 |
 下列有机物中,有多个官能团:可以看作醇类的是
下列有机物中,有多个官能团:可以看作醇类的是