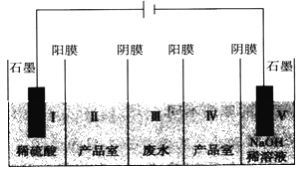
题目内容
【题目】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
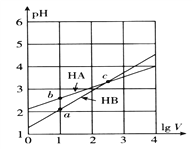
A. HA是弱酸,HB是强酸
B. 相同温度、相同浓度的NaA、NaB溶液的pH,后者大
C. c点处,分别加入足量的锌粒,HA中产生氢气多
D. a、b、c三点,由水电离出来的c(H+)·c(OH-)相等
【答案】C
【解析】A. 根据图像,体积均为1L的HA、HB的两种一元酸溶液,稀释100倍,溶液的pH变化小于2,说明HA和HB都是弱酸,故A错误;B. 根据图像,稀释相同的倍数,HA的pH变化小,说明酸性HB>HA,则相同温度、相同浓度的NaA、NaB溶液,NaA的水解程度大,pH大,故B错误;C. 酸性HB>HA,c点处,两溶液的pH相同,则HA的物质的量浓度大于HB,分别加入足量的锌粒,HA中产生氢气多,故C正确;D. a、b两溶液的pH相同,由水电离出来的c(H+)·c(OH-)相等、c点pH大,由水电离出来的c(H+)·c(OH-)小,故D错误;故选C。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目