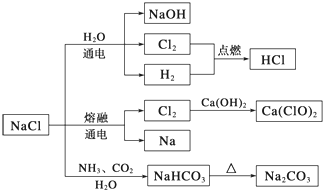
题目内容
【题目】某固体样品由Na2CO3和NaHCO3两种试剂组成,现取27.4g该样品置于试管中,充分加热后干燥称重,固体的质量变为21.2g,试求:
(1)样品中NaHCO3的质量为___________g。
(2)向分解后的固体中加入2mol·L-1的盐酸,使之完全转化为NaCl,所需盐酸的体积至少为_______L。
【答案】 16.8 0.2
【解析】(1). 某固体样品由Na2CO3和NaHCO3两种试剂组成,现取27.4g该样品置于试管中,充分加热,NaHCO3受热分解生成Na2CO3、CO2和H2O,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,干燥称重,固体的质量变为21.2g,则固体质量减少了:27.4g-21.2g=6.2g,设样品中NaHCO3的物质的量为xmol,则:
Na2CO3+CO2↑+H2O,干燥称重,固体的质量变为21.2g,则固体质量减少了:27.4g-21.2g=6.2g,设样品中NaHCO3的物质的量为xmol,则:
2NaHCO3![]() Na2CO3+CO2↑+H2O △ m
Na2CO3+CO2↑+H2O △ m
2mol 62g
xmol 6.2g
![]() =
=![]() ,解得x=0.2mol,则NaHCO3的质量为:0.2mol×84g/mol=16.8g,故答案为:16.8;
,解得x=0.2mol,则NaHCO3的质量为:0.2mol×84g/mol=16.8g,故答案为:16.8;
(2). 样品充分加热分解后得到的是Na2CO3固体,由上述计算可知,原样品中Na2CO3的物质的量为:(27.4-16.8)g÷106g/mol=0.1mol,0.2molNaHCO3受热分解生成0.1molNa2CO3,则加热分解后Na2CO3的物质的量为0.2mol,向固体中加入2mol·L-1的盐酸,使之完全转化为NaCl,反应方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,由反应方程式可知,0.2molNa2CO3完全反应需要0.4molHCl,则所需盐酸的体积为:V(HCl)=0.4mol÷2mol·L-1=0.2L,故答案为:0.2。

练习册系列答案
相关题目