题目内容
反应N2+3H2?2NH3在恒温恒容密闭容器中进行,如果起始时c(N2)=4mol/L,C(H2)=8mol/L,经过5min反应达到平衡时有10%的N2转化,求:
(1)5min内NH3的平均反应速率是多少?
(2)平衡时NH3占总体积百分数是多少?
(3)平衡时和起始时的压强比为多少?
(1)5min内NH3的平均反应速率是多少?
(2)平衡时NH3占总体积百分数是多少?
(3)平衡时和起始时的压强比为多少?
依据化学平衡三段式列式计算,经过5min反应达到平衡时有10%的N2转化说明反应的浓度=4mol/L×10%=0.4mol/L;
N2 +3H2?2NH3
起始(mol/L)480
转化(mol/L)0.41.20.8
平衡(mol/L)3.66.80.8
(1)5min 内NH3的平均反应速率V(NH3)=
=0.16mol/(L?min),
答:5min 内NH3的平均反应速率是0.16 mol/(L?min);
(2)平衡时NH3占总体积百分数为=
×100%=
×100%=7.14%,
答:平衡时NH3占总体积百分数为7.14%;
(3)平衡后气体压强之比等于气体物质的量之比,P平:P始=11.2:12=14:15,
答:平衡时和起始时的压强比为14:15;
N2 +3H2?2NH3
起始(mol/L)480
转化(mol/L)0.41.20.8
平衡(mol/L)3.66.80.8
(1)5min 内NH3的平均反应速率V(NH3)=
| 0.8mol/L |
| 5min |
答:5min 内NH3的平均反应速率是0.16 mol/(L?min);
(2)平衡时NH3占总体积百分数为=
| 0.8 |
| 4+8-0.8 |
| 0.8 |
| 11.2 |
答:平衡时NH3占总体积百分数为7.14%;
(3)平衡后气体压强之比等于气体物质的量之比,P平:P始=11.2:12=14:15,
答:平衡时和起始时的压强比为14:15;

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
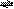
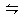 N2O4,下列说法能证明反应已达平衡状态的是
N2O4,下列说法能证明反应已达平衡状态的是 