题目内容
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
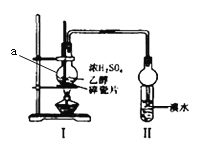
(1)仪器a的名称为____________,II中球形干燥管的作用是_______________,碎瓷片的作用___________;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是______(填字母序号);
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.温度过高导致浓硫酸被还原产生的SO2也会使溴水褪色
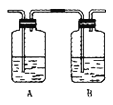
(3)丙同学对上述实验装置进行了改进,在I和II之间增加如图装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________。
(4)写出该实验中生成乙烯的化学方程式:___________________________
【答案】圆底烧瓶 防止倒吸 防止暴沸 BC NaOH溶液 吸收SO2 品红溶液 CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
【解析】
(1)根据仪器的结构判断仪器a;乙烯与溴水发生加成反应,会造成烧瓶中气体的压强减小,反应在170℃时发生,液体容易暴沸,据此分析解答;
(2)浓硫酸具有强烈的脱水性和氧化性,能将乙醇脱水生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(4)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,据此书写反应的方程式。
(1)根据图示,仪器a为圆底烧瓶;乙烯与溴水发生加成反应,会造成烧瓶中气体的压强减小,II中球形干燥管可以防止倒吸,碎瓷片可以防止液体暴沸,故答案为:圆底烧瓶;防止倒吸;防止暴沸;
(2)浓H2SO4具有强烈的脱水性和氧化性,能将乙醇脱水生成碳,自身被还原生成二氧化硫,C+2H2SO4![]() CO2↑+2SO2↑+2H2O,SO2具有还原性,也可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
CO2↑+2SO2↑+2H2O,SO2具有还原性,也可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验是否存在二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,故答案为:NaOH溶液;吸收SO2;品红溶液;
(4)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH ![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。

 口算能手系列答案
口算能手系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。