题目内容
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
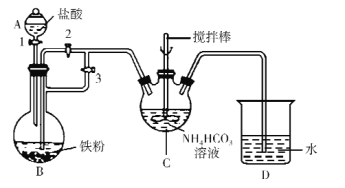
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。

则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
【答案】三颈烧瓶 制备Fe2+,利用产生的氢气排净装置内的空气,防止Fe2+被氧化 3 2 Fe2++2HCO3=FeCO3↓+CO2↑+H2O 液封,防止空气中的氧气进入到C装置中,将Fe2+氧化 防止FeCO3与乳酸反应产生的Fe2+被氧化 乳酸(根中的羟基)被酸性高锰酸钾溶液氧化 97.50
【解析】
(1)根据化学反应实验原理进行分析判断。(2)根据实验用到的仪器装置进行分析解答相关的问题;(3)根据化学反应方程式找出相关物质的关系式进行计算。
(1)由装置图可知仪器C的名称是三颈烧瓶。答案:三颈烧瓶。
(2)为顺利达成实验目的,先要使盐酸与铁粉反应制备FeCl2。先关闭活塞2,打开活塞1、3,待加入足量盐酸后,关闭活塞1,反应一段时间后,利用生成的H2使B装置中的气压增大,将B装置中的FeCl2溶液加入到C装置中,具体操作为:关闭活塞3,打开活塞2。C装置中FeCl2和NH4HCO3发生的反应的离子方程式为Fe2++2HCO3=FeCO3↓+CO2↑+H2O。答案:制备Fe2+;利用产生的氢气排净装置内的空气,防止Fe2+被氧化;2;3;Fe2++2HCO3=FeCO3↓+CO2↑+H2O。
(3)亚铁离子易被氧化,装置D的作用是液封,防止空气中的氧气进入到C装置中,将Fe2+氧化
(4)Fe2+易被氧化为Fe3+,实验目的是制备乳酸亚铁晶体,加入少量铁粉的作用,可以防止FeCO3与乳酸反应产生的Fe2+被氧化。答案:防止FeCO3与乳酸反应产生的Fe2+被氧化。
(5)乳酸根中含有羟基,可能被酸性高锰酸钾溶液氧化,导致消耗的高锰酸钾的量变多,而计算中按Fe2+被氧化,故计算所得的乳酸亚铁的质量偏大,产品中乳酸亚铁的纯度大于100%。答案:乳酸根中的羟基被酸性高锰酸钾溶液氧化。
(6)3组数据,第二组数据与第一、三组相差太大,应舍去,平均每25.00mL消耗Ce(SO4)2的体积为v=![]() mL=19.50mL,有Ce4++ Fe2+=Ce3++ Fe3+,25.00mL溶液中含有的Fe2+的物质的量浓度为c(Fe2+)=(19.50
mL=19.50mL,有Ce4++ Fe2+=Ce3++ Fe3+,25.00mL溶液中含有的Fe2+的物质的量浓度为c(Fe2+)=(19.50![]() 0.1)/25.00mol/L=0.078mol/L,则250mL溶液中,原产品中含有n(Fe2+)=0.078mol/L
0.1)/25.00mol/L=0.078mol/L,则250mL溶液中,原产品中含有n(Fe2+)=0.078mol/L![]() 0.25L=0.0195mol,则产品中乳酸亚铁晶体的质量分数为
0.25L=0.0195mol,则产品中乳酸亚铁晶体的质量分数为![]() =97.50
=97.50![]() 答案:97.50。
答案:97.50。

 阅读快车系列答案
阅读快车系列答案【题目】光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为___,第8 min时改变的条件是____。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___(填“增大”“不变”或“减小”),原因是_____。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)![]() COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2![]() 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl + CO![]() COCl 快速平衡
COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____(填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
1 | 0.100 | 0.100 | 1.2×10-2 |
2 | 0.050 | 0.100 | 4.26×10-3 |
3 | 0.100 | 0.200 | 2.4×10-2 |
4 | 0.050 | 0.050 | 2.13×10-3 |
CO的反应级数m =___,当实验4进行到某时刻,测得c(Cl2) = 0.010mol·L-1,则此时的反应速率v =___mol·L-1·s-1(已知:![]() ≈ 0.32)。
≈ 0.32)。


