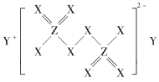
题目内容
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3和SiO2等物质。综合利用粉煤灰不仅能防止环境污染,还能获得纳米Fe2O3等重要物质。
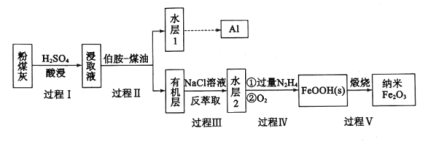
回答下列问题:
(1)过程Ⅰ对粉煤灰进行酸浸过滤后,滤渣的主要成分是_____。
(2)过程Ⅱ加入伯胺—煤油后,将浸取液进行分离的操作名称是___;伯胺(R-NH2)能与Fe3+反应生成易溶于煤油的![]() ,该反应的离子方程式为____。
,该反应的离子方程式为____。
(3)过程Ⅲ,利用NaCl溶液进行“反萃取”发生了______变化(填“物理”或“化学”)。
(4)过程Ⅳ分两步完成,先是过量的N2H4将水层2中的铁元素转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH。其中第一步反应生成的含氮微粒的化学式为______。
(5)纳米Fe2O3是一种多功能材料,常压下用纳米Fe2O3电化学法合成氨的装置如图所示,其中电解液为熔融NaOH—KOH,该装置工作时可循环利用的物质是___。实验测得纳米Fe2O3在反应前后的质量和化学性质均未变,其颗粒大小变为毫米级,则说明纳米Fe2O3在电极上发生的反应过程如下:__(用化学用语表示)。

【答案】SiO2 分液 ![]()
或![]() ) 化学 N2和N2H5+ H2O
) 化学 N2和N2H5+ H2O ![]() ,
,![]()
或![]() ,
,![]()
或![]() ,
,![]()
【解析】
粉煤灰用H2SO4浸泡,其中的Al2O3和Fe2O3会与H2SO4反应生成,Al2(SO4)3、Fe2(SO4)3;而SiO2不反应,是沉淀,过滤除去;用伯胺-煤油萃取,Fe3+与伯胺反应,进入煤油中,从而与Al3+分离,再用NaCl溶液,反萃取Fe3+进入水层,再反应得到FeOOH,最后得到纳米Fe2O3。
(1)粉煤灰用H2SO4浸泡,其中的Al2O3和Fe2O3会与H2SO4反应生成,Al2(SO4)3、Fe2(SO4)3;而SiO2不反应,是沉淀,过滤除去,滤渣的主要成分是SiO2;
(2)伯胺-煤油萃取后,得到是互不相溶的液体,分离互不相溶的液体用分液;根据电荷守恒,可配平方程式![]() ;
;
(3)过程Ⅲ,利用NaCl溶液进行“反萃取”,Fe3+从有机层进入到水层,说明Fe3+形成的物质发生变化,从易溶于有机物的物质变成了易溶于水的物质,因此发生了化学变化;
(4)反萃取后,水溶液中存在Fe3+,与N2H4反应转化为Fe2+,Fe的化合价降低,因此N的化合价升高,根据得失电子守恒和电荷守恒,可得离子方程式为4Fe3++5N2H4=4Fe2++N2+4N2H5+,含氮微粒的化学是为N2和N2H5+;
(5)根据示意图,N2和H2O转化了NH3,N的化合价降低,发生了还原反应,电极方程式为N2+6H2O+6e-=2NH3+6OH-;而另一极,OH-失去生成O2,4OH--4e-=O2↑+2H2O;N2和H2O反应消耗了水,而OH-放电又生成了水,因此可循环利用的物质是H2O;
纳米Fe2O3在反应前后的质量和化学性质均未变,其颗粒大小变为毫米级,说明Fe2O3是该反应的催化剂;OH-在右侧电极失去电极,说明左侧电极得到电子发生还原反应,因此可能为Fe2O3先得到电子发生还原反应,得到还原产物,再与N2反应;Fe2O3中Fe的化合价是+3,得到电子化合价降低可能得到还原产物Fe、Fe3O4、FeO;则纳米Fe2O3在电极上发生的反应过程可能为![]() ,
,![]() 或
或![]() ,
,![]() 或
或![]() ,
,![]()

 名校课堂系列答案
名校课堂系列答案【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
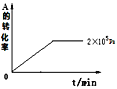
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
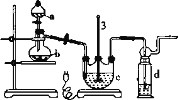
(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1