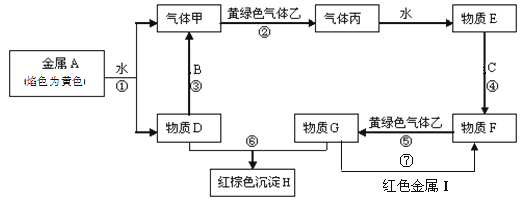
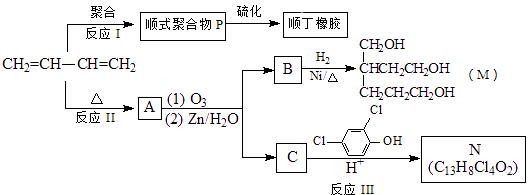
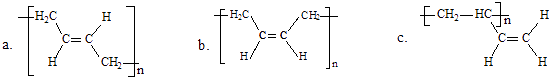题目内容
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察: 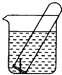
①铁钉在逐渐生绣.
②若试管内液面上升,发生腐蚀,正极: .
③若试管内液面下降,则原溶液呈性,正极: .
【答案】吸氧;2H2O+O2+4e﹣=4OH﹣;酸;2H++2e﹣=H2↑
【解析】解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,①若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,原溶液呈中性,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+ , 正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣ , 所以答案是:吸氧;2H2O+O2+4e﹣=4OH﹣;②若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+ , 正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑,所以答案是:酸;2H++2e﹣=H2↑.
【考点精析】本题主要考查了金属的电化学腐蚀与防护的相关知识点,需要掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能正确解答此题.

【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)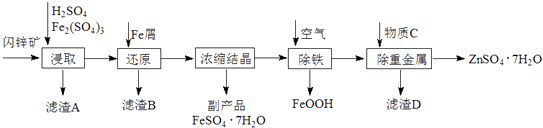
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.