题目内容
【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)下图所示的模型表示的分子中,可由A、D形成的是________。


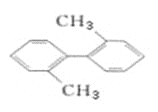
写出c分子的空间构型为_________,d分子的结构简式 _________。
(2)关于d分子有下列问题:
①d分子中同一平面的原子最多有_______个。
②若用-C4H9取代环上的一个H原子,得到的有机物的同分异构体共有__________种。
(3)Na在F单质中燃烧产物的电子式为______。上述元素的最高价氧化物的水化物中,碱性最强的是______ (写化学式) ,其与Q的单质反应的离子方程式是_____________。
【答案】acd 正四面体 ![]() 13 12
13 12 ![]() KOH 2Al+2OH-+2H2O=2AlO-2+3H2↑
KOH 2Al+2OH-+2H2O=2AlO-2+3H2↑
【解析】
根据元素所在周期表中的位置可知A为H元素,D为C元素,F为O元素,G为Mg元素,Q为Al元素,M为S元素,R为Cl元素,N为K元素,结合原子结构和物质的性质分析解答。
根据元素所在周期表中的位置可知A为H元素,D为C元素,F为O元素,G为Mg元素,Q为Al元素,M为S元素,R为Cl元素,N为K元素。
(1)A为H元素,D为C元素,根据图示,a表示乙烯,b表示氨气,c表示甲烷,d表示甲苯,由A、D形成的是acd;甲烷为正四面体;甲苯的结构简式为![]() ,故答案为:acd;正四面体;
,故答案为:acd;正四面体;![]() ;
;
(2)①苯环为平面结构,碳碳单键可以旋转,因此甲苯中最多有13个原子共面,故答案为:13;
②-C4H9有4种结构,碳架结构分别为:![]() 、
、![]() 、
、![]() 、
、![]() ,取代苯环上的一个H原子,可以得到邻位、间位、对位共12种同分异构体,故答案为:12;
,取代苯环上的一个H原子,可以得到邻位、间位、对位共12种同分异构体,故答案为:12;
(3)Na在O2中燃烧生成Na2O2,过氧化钠为离子化合物,电子式为![]() ;上述元素中,金属性最强的元素为第四周期ⅠA族元素K,对应最高价氧化物的水化物KOH的碱性最强,与Al反应的离子方程式为2Al+2OH-+2H2O=2AlO-2+3H2↑,故答案为:
;上述元素中,金属性最强的元素为第四周期ⅠA族元素K,对应最高价氧化物的水化物KOH的碱性最强,与Al反应的离子方程式为2Al+2OH-+2H2O=2AlO-2+3H2↑,故答案为:![]() ;KOH;2Al+2OH-+2H2O=2AlO-2+3H2↑。
;KOH;2Al+2OH-+2H2O=2AlO-2+3H2↑。

 名校课堂系列答案
名校课堂系列答案