��Ŀ����
����Ŀ������������һ����Ҫ�������ըҩ�����Ի������о�����Ԫ�زⶨ����Խ��Խ�������ǵ����ӣ������������(HN3)��һ�����ᣬ���ӽṹʾ��ͼ�ɱ�ʾΪ��
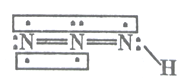
����������������ʱ��������������(HN3)��N2H4+HNO2=2H2O+HN3���������������ڴ��ᣬ�������H+��N3-���Իش��������⣺
(1)�ӳɼ�ԭ�ӵĵ縺�ԽǶ���HN3�к��еĹ��ۼ�����Ϊ_______________�����ӵļ���Ϊ_____________��
(2)������������Fe3+��Cu2+��Co3+���γ������磺Co[(N3)(NH3)5]SO4���ڸ������������_________�ۣ����ݼ۲㻥�����ۿ�֪SO42-�ռ���״Ϊ______________��д����ԭ���ڻ�̬ʱ�ĺ�������Ų�ʽ_____________��
(3)�ɵ�������(NaN3)�ȷֽ�ɵô�N2��2NaN3(s)=2Na(l)+3N2(g)���й�˵����ȷ����__________(ѡ�����)
A.NaN3��KN3�ṹ���ƣ�ǰ�߾����ܽ�С
B.�ƾ����ṹ��ͼ![]() �������з�̯2����ԭ��
�������з�̯2����ԭ��
C.���ĵ�һ�����ܴ�����
D.���������º��ȶ�������Ϊ���ĵ縺��С
(4)��N3-��Ϊ�ȵ�����ķ�����___________________ (��2����
(5)���������������Ӳ�Ƚ����ڽ��ʯ��ԶԶ�����������ϣ����������ʯͳ��Ϊ��Ӳ���ϡ�������������ͼ��ʾ���Է�����
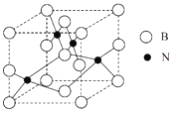
���þ�������Ϊ____________���塣
�ھ�����ÿ��Nͬʱ����________��B��
����þ����Ħ������ΪMg��mol-1��������ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪNA���������������������B֮��ľ���Ϊ___________cm��
���𰸡� ���Լ����Ǽ��Լ� ���Է��� +3 �������� ls22s22p63s23p63d74s2��[Ar]3d74s2 BC N2O��CO2��CS2��BeF2�� ԭ�� 4 ![]()
��������(1) HN3�к��еĹ��ۼ���H-N���Լ���N=N�Ǽ��Լ������ݽṹ��֪���÷���ΪV�η��ӣ���ɷֲ������ȣ����ڼ��Է��ӣ��ʴ�Ϊ�����Լ����Ǽ��Լ������Է�����
(2)��������е����������Ϊ-1�ۡ����������Ϊ-2�ۣ����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0֪��CoԪ�ػ��ϼ�Ϊ+3�ۣ���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӿռ乹��Ϊ���������Σ�Co��27��Ԫ�أ���ԭ�Ӻ�����27�����ӣ����ݹ���ԭ����д���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2���ʴ�Ϊ��+3���������壻1s22s22p63s23p63d74s2��[Ar]3d74s2��
(3)A��NaN3��KN3�ṹ���ƣ��Ҷ��߶������Ӿ��壬�����������Ӱ뾶�ɷ��ȣ������Ӱ뾶���������ӣ�����ǰ�߾����ܴ��ں��ߣ��ʴ���B��������Naԭ�Ӹ���=8��![]() +1=2������ȷ��C��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ����Ե�һ������N��O������ȷ��D�����������к��е������������ܽϴ����ʽ��ȶ����ʴ���ѡBC��
+1=2������ȷ��C��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ����Ե�һ������N��O������ȷ��D�����������к��е������������ܽϴ����ʽ��ȶ����ʴ���ѡBC��
(4)ԭ�Ӹ�����ȼ۵�������ȵ�����Ϊ�ȵ����壬��N3-��Ϊ�ȵ�����ķ�����N2O��CO2��CS2��BeF2�ȣ��ʴ�Ϊ��N2O��CO2��CS2��BeF2�ȣ�
(5)��ԭ�Ӿ���Ӳ�ȴþ���Ӳ�ȴ�����Ϊԭ�Ӿ��壬�ʴ�Ϊ��ԭ�ӣ�
��ÿ��Nԭ��ͬʱ����4��Bԭ�ӣ���������λ����4���ʴ�Ϊ��4��
�۾������������������B֮��ľ���Ϊ�����ⳤ��![]() ���������ⳤ=
���������ⳤ=![]() ���������������������B֮��ľ���=
���������������������B֮��ľ���=![]() ��
��![]() cm=
cm=![]() ��
��![]() cm=
cm=![]() cm���ʴ�Ϊ��
cm���ʴ�Ϊ��![]() ��
��

����Ŀ�������и�����Ϻ͵������Һ�����ԭ��ص���
ѡ�� | A | B | C | D |
�������� | Mg��Mg | Zn��Fe | ���ʯ��Cu | Zn��Cu |
�������Һ | ϡH2SO4 | �Ҵ� | Ũ H2SO4 | ϡ���� |
A. A B. B C. C D. D





