题目内容
【题目】短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素.试回答以下问题:
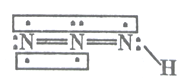
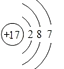
(1)写出D与E以1:2的原子个数比形成的化合物的电子式: . F的原子结构示意图为 .
(2)B,D形成的化合物BD2中存在的化学键为键(填“离子”或“共价”,下同).A,C,F三种元素形成的化合物CA4F为化合物.
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为 .
(4)元素B和F的非金属性强弱,B的非金属性于F(填“强”或“弱”),并用化学方程式证明上述结论 .
【答案】
(1)![]() ;
;
(2)共价;离子
(3)OH﹣+HCO3﹣═CO32﹣+H2O
(4)弱;Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
【解析】解:短周期主族元素A、B、C、D、E、F的原子序数依次增大,由B形成的化合物种类繁多,可知B为C元素;根据C、D为空气中含量最多的两种元素,且C、D的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,A的电子层数为13﹣2﹣2﹣2﹣3﹣3=1,则A为H元素,(1)D与E以1:2的原子个数比形成的化合物为Na2O,其电子式为 ![]() ,F为Cl元素具有17个质子和17个电子,原子结构示意图为
,F为Cl元素具有17个质子和17个电子,原子结构示意图为 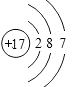 ,故答案为:
,故答案为: ![]() ;
;  ;(2)B、D形成的化合物CO2中存在的化学键为共价键;A、C、F三种元素形成的化合物CA4F为NH4Cl,含有离子键属于离子化合物,故答案为:共价;离子;(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲和乙可能是NaOH和NaHCO3 , 其反应的离子方程式为OH﹣+HCO3﹣═CO32﹣+H2O,故答案为:OH﹣+HCO3﹣═CO32﹣+H2O;(4)元素B和F的分别为C、Cl,非金属性C比Cl弱,高氯酸能制备碳酸,则高氯酸的酸性大于碳酸,即非金属性,Cl大于C,其反应方程为:Na2CO3+2HClO4═CO2↑+H2O+2NaClO4 ,
;(2)B、D形成的化合物CO2中存在的化学键为共价键;A、C、F三种元素形成的化合物CA4F为NH4Cl,含有离子键属于离子化合物,故答案为:共价;离子;(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲和乙可能是NaOH和NaHCO3 , 其反应的离子方程式为OH﹣+HCO3﹣═CO32﹣+H2O,故答案为:OH﹣+HCO3﹣═CO32﹣+H2O;(4)元素B和F的分别为C、Cl,非金属性C比Cl弱,高氯酸能制备碳酸,则高氯酸的酸性大于碳酸,即非金属性,Cl大于C,其反应方程为:Na2CO3+2HClO4═CO2↑+H2O+2NaClO4 ,
故答案为:弱;Na2CO3+2HClO4═CO2↑+H2O+2NaClO4 .
短周期主族元素A、B、C、D、E、F的原子序数依次增大,由B形成的化合物种类繁多,可知B为C元素;根据C、D为空气中含量最多的两种元素,且C、D的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,A的电子层数为13﹣2﹣2﹣2﹣3﹣3=1,则A为H元素,然后结合元素及其单质、化合物的性质来解答.

【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。