题目内容
在密闭容器中盛有H2、O2、Cl2混合气体,通过电火花引燃,气体恰好完全反应,冷却至室温后,所得液体产物中HCl的质量分数为25.62%,则容器中原有H2、O2、Cl2分子个数比为( )
| A.6∶3∶2 | B.9∶6∶1 | C.10∶6∶1 | D.13∶6∶1 |
D
设有100 g溶液,则其中HCl:25.62 g即0.705 mol。
含H2O:74.38 g即4.13 mol,故n(Cl2)=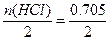 mol,n(O2)=
mol,n(O2)=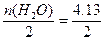 mol,n(H2)=
mol,n(H2)=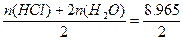 mol。
mol。
故n(H2)∶n(O2)∶n(Cl2)=13∶6∶1。
含H2O:74.38 g即4.13 mol,故n(Cl2)=
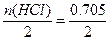 mol,n(O2)=
mol,n(O2)=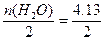 mol,n(H2)=
mol,n(H2)=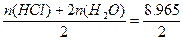 mol。
mol。故n(H2)∶n(O2)∶n(Cl2)=13∶6∶1。

练习册系列答案
相关题目