题目内容
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2—、CO32—、SO42—中的若干种离子组成,取该溶液进行如下实验:
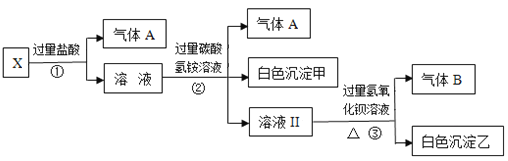
(1)气体B的成分是______________。
(2)写出步骤②形成白色沉淀甲的离子方程式__________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_________________________,尚未确定是否存在的离子是__________________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是_________________________________。
【答案】 NH3 Al3+ +3HCO3- === Al(OH)3 ↓+ 3CO2 ↑ CO32- 、 AlO2- 、Na+ SO42- 在沉淀乙中加入过量稀硝酸,若有沉淀不溶解的现象存在,说明有该离子,若沉淀全溶则无该离子
【解析】溶液呈无色,则不含Fe3+,加入过量盐酸只产生气体,则一定含有CO32—,不含Ag+,反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,则原溶液中含有AlO2—,则一定不含Ba2+、Al3+、Fe3+,因这些离子与 AlO2—发生相互促进的水解而不能大量共存,根据溶液电中性原则,一定含有Na+,最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定SO42—是否存在;据以上分析解答。
溶液呈无色,则不含Fe3+,加入过量盐酸只产生气体,则一定含有CO32—,不含Ag+,反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,则原溶液中含有AlO2—,则一定不含Ba2+、Al3+、Fe3+,因这些离子与 AlO2—发生相互促进的水解而不能大量共存,根据溶液电中性原则,一定含有Na+,最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定SO42—是否存在。
(1)气体A的成分是CO2,所涉及反应有:CO32-+2H+=H2O+CO2↑, Al3++3HCO3-=Al(OH)3↓+3CO2↑,气体B为NH3,所涉及反应为:NH4++OH-=NH3↑+H2O;正确答案: NH3 。
(2) 溶液中含有AlO2—,加入过量盐酸发生反应: AlO2—+4H+=Al3++2H2O,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应为: Al3++3HCO3- ===Al(OH)3↓+3CO2↑;正确答案: Al3+ +3HCO3- === Al(OH)3 ↓+ 3CO2↑。
(3)由以上分析可以知道,X溶液中一定存在的离子是CO32-、AlO2- 、Na+ ,因最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定SO42—是否存在;可向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42—;正确答案:CO32-、AlO2- 、Na+ ;SO42- ;在沉淀乙中加入过量稀硝酸,若有沉淀不溶解的现象存在,说明有该离子,若沉淀全溶则无该离子。

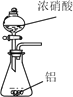
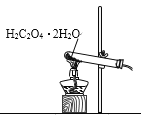
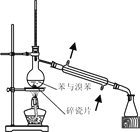
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为 101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. AB. BC. CD. D