题目内容
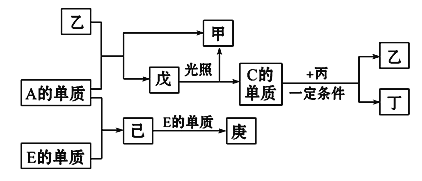
【题目】B、D、C、A、E五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)写出E的原子结构示意图_________________________。
(2)写出C、D氢化物的稳定性由强到弱的顺序____________。(用化学式表示)。
(3)A、B、D三种元素形成的化合物中,含有化学键的类型为___________。
(4)写出C与丙反应的化学反应方程式_________________________________。
(5)写出工业上从海水中制取A的离子反应方程式____________________________。
(6)工业上通过如下转化可制得含A元素的钾盐KAO3晶体:

①完成Ⅰ中反应的总化学方程式: ________
NaA+ H2O![]() NaAO3+
NaAO3+
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是__________________。
【答案】 ![]() H2O>NH3 离子键、共价键
H2O>NH3 离子键、共价键 ![]() 2Cl-+2H2O
2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 1NaCl+3H2O
Cl2↑+H2↑+2OH- 1NaCl+3H2O![]() 1NaClO3+3H2↑ 室温下,氯酸钾在水中的溶解度明显小于其他晶体
1NaClO3+3H2↑ 室温下,氯酸钾在水中的溶解度明显小于其他晶体
【解析】D、C元素在元素周期表中位置相邻,C的单质和D的单质化合可得丁,戊、己、庚均为化合物,所以D为氮元素,C为氧元素,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,已知乙、丙每个分子中均含有10个电子,则B为氢元素,结合框图中A的单质和E的单质反应生成已,已又能与E单质反应说明E为变价金属,即为铁,则A为氯元素。所以可以推知B:氢;D:氮;C:氧;A:氯;E:铁。甲为氯化氢,乙为水,丙为氨气,丁为一氧化氮,戊为次氯酸,已为氯化铁,庚为氯化亚铁。
(1).通过以上分析,E为铁,其原子结构示意图为![]() ,故答案为:
,故答案为: ![]() ; (2). 氮和氧的氢化物分别为氨气和水,非金属性越强,氢化物越稳定,所以稳定性顺序为H2O>NH3,故答案为:H2O>NH3; (3). A、B、D三种元素形成的化合物中为氯化铵,含有离子键和共价键,故答案为:离子键、共价键;
; (2). 氮和氧的氢化物分别为氨气和水,非金属性越强,氢化物越稳定,所以稳定性顺序为H2O>NH3,故答案为:H2O>NH3; (3). A、B、D三种元素形成的化合物中为氯化铵,含有离子键和共价键,故答案为:离子键、共价键;
(4)写出C与丙反应的化学反应为氧气和氨气反应产生一氧化氮和水,方程式为![]() ,故答案为:
,故答案为:![]()
(5)写出工业上从海水中制取氯气是用电解氯化钠生成氢氧化钠和氯气和氢气,离子反应方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH- ; (6). ①完成Ⅰ中反应为电解氯化钠溶液得到氯酸钠和氢气,方程式为: 1NaCl+3H2O
Cl2↑+H2↑+2OH- ; (6). ①完成Ⅰ中反应为电解氯化钠溶液得到氯酸钠和氢气,方程式为: 1NaCl+3H2O![]() 1NaClO3+3H2↑;②室温下,氯酸钾在水中的溶解度明显小于其他晶体,所以Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出,故答案为:室温下,氯酸钾在水中的溶解度明显小于其他晶体。
1NaClO3+3H2↑;②室温下,氯酸钾在水中的溶解度明显小于其他晶体,所以Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出,故答案为:室温下,氯酸钾在水中的溶解度明显小于其他晶体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


