题目内容
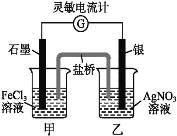
【题目】某化学兴趣小组,利用如图所示装置探究元素非金属性强弱的变化规律。
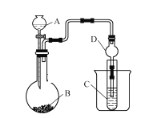
(1)仪器A的名称为_________,干燥管D的作用是_____。
(2)实验室中现有药品Na2S、浓盐酸、稀硫酸、MnO2,请选择合适药品设计实验探究氯和硫的非金属性强弱(必要时可以加热,图中省略):
①装置A中所装药品为_________。
②装置C中的实验现象为:有淡黄色沉淀生成,该装置中的化学反应方程式为__________。
③根据该实验探究出的结果,可知HCl的稳定性比H2S的稳定性____。(填“强”或“弱”)
(3)若要探究硫和碳元素的非金属性强弱,B、C中所装药品分别为Na2CO3固体、澄清石灰水,则A中反应的离子方程式为__________,观察到C装置中的现象为_________。
【答案】分液漏斗 防止倒吸 浓盐酸 Na2S+Cl2﹦2NaCl+S↓ 强 2H++CO32-=H2O+CO2↑ 石灰水变浑浊
【解析】
(1)根据仪器的构造写出仪器A的名称;球形干燥管D可以避免C中液体进入锥形瓶中;
(2)要证明氯和硫的非金属性强弱,可以通过氯气与硫化钠发生氧化还原反应生成单质硫来证明;非金属性越强,气态氢化物越稳定;
(3)要证明硫和碳元素的非金属性,可以通过硫酸和碳酸钠反应生成二氧化碳气体来证明。
(1)仪器A为分液漏斗,球形干燥管D可以避免C中液体进入锥形瓶中,起到防止倒吸的作用;
(2)①通过氯气与硫化钠发生氧化还原反应生成单质硫来证明氯和硫的非金属性强弱,装置B用来制备氯气,浓盐酸与二氧化锰或高锰酸钾反应可以生成氯气,所以B中加入二氧化锰或高锰酸钾,A中加入浓盐酸;
②装置C中盛放硫化钠溶液,氯气通入硫化钠溶液,反应生成氯化钠和单质硫,反应方程式是Na2S+Cl2﹦2NaCl+S↓;
③C中生成单质硫说明氯气氧化性大于硫,从而证明非金属性:Cl>S;非金属性越强,气态氢化物越稳定,所以HCl的稳定性比H2S的稳定性强;
(3)要证明硫和碳元素的非金属性,可以通过硫酸和碳酸钠反应生成二氧化碳气体来证明,A装置中盛放稀硫酸,B中所装药品为Na2CO3固体,B中碳酸钠与硫酸反应生成硫酸钠、二氧化碳和水,反应离子方程式是2H++CO32-=H2O+CO2↑,C中所装药品澄清石灰水,二氧化碳与石灰水反应生成碳酸钙沉淀,C装置中的现象为石灰水变浑浊。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25