题目内容
 某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.
某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.
(1)甲同学设计了如图所示的装置,并认为由广口瓶中溶液颜色的变化可以达到实验目的,甲作出此判断的依据是______.
(2)乙同学通过分析指出甲同学的装置图有两处不合理,并进行了修改,修改的内容:______.
按修改后的装置,实验中控制SO2以大约每分钟200个气泡的速率通过品红的酒精溶液,20分钟后溶液仍不褪色,由此知,品红的褪色不是______直接导致的.随后乙同学对SO2使品红溶液褪色的微粒提出了如下三种假设:
假设一:是HSO ;
;
假设二:是SO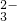 ;
;
假设三:______.
(3)为验证自己的假设,乙同学进行了如下实验:取2mL相同浓度的品红的酒精溶液置于两支试管中,再向试管中分别加入少量Na2SO3、NaHSO3固体,振荡静置后发现试管中的液体均褪色,对此他们得出使品红褪色的粒子是HSO 、SO
、SO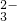 的结论,你认为此结论是否正确?______(填“是”或“否”),理由是______.
的结论,你认为此结论是否正确?______(填“是”或“否”),理由是______.
(4)为了进一步进行探究,丙同学又做了如下实验:取相同浓度的品红的酒精溶液各10mL分别置于两个小烧杯中,向两个烧杯中同时一次陛性地加久10mL 0.1mol/L Na2SO3、10mL 0.1mol/LNaHSO3溶液,发现加入Na2SO3溶液的褪色较快.对此他可以得出的结论是______,理由是______.
解:(1)酒精的品红溶液中不含水,二氧化硫直接和品红反应而使品红褪色,所以其作用的是二氧化硫,
故答案为:酒精的品红溶液中不含水,二氧化硫直接和品红反应;
(2)该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥;二氧化硫有毒,所以多余气体不能直接排空,故要有尾气处理装置,
二氧化硫和水反应生成亚硫酸,SO2+H2O?H2SO3,亚硫酸是二元弱酸,所以能发生两步电离,第一步生成氢离子和亚硫酸氢根离子,亚硫酸氢根离子电离生成亚硫酸根离子和氢离子,H2SO3?H++HSO3-,HSO3-?H++SO32-,以上反应都是可逆反应,所以存在的含有硫元素的微粒有(除二氧化硫外)H2SO3、HSO3-、SO3 2-,
故答案为:①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);②没有尾气吸收装置;H2SO3;
(3)亚硫酸钠和亚硫酸氢钠都是强碱弱酸盐,都能发生水解,水解反应方程式为:亚硫酸钠的水解:SO32-+H2O=HSO3-+OH-、HSO3-+H2O=H2SO3+OH-;亚硫酸氢钠的水解,HSO3-+H2O=H2SO3+OH-,通过水解方程式看出,无论亚硫酸钠还是亚硫酸氢钠都能水解生成亚硫酸,故该说法错误,
故答案为:否;因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸;
(4)Na2SO3和NaHSO3都能电离和水解,但水解是微弱的,电离程度大于水解程度;HSO3-能电离出SO32-,但较弱,则Na2SO3溶液中的SO32-比NaHSO3溶液中的大,Na2SO3使酒精品红溶液褪色快,说明起漂白作用的是SO32-,
故答案为:使品红褪色的微粒是SO32-;SO32-离子浓度大,褪色快,而SO32-浓度小时,褪色慢.
分析:(1)根据酒精品红溶液中的成分判断哪种物质和品红反应;
(2)根据实验目的及二氧化硫的性质分析,应制取干燥的二氧化硫气体;二氧化硫有毒,应有尾气处理装置;
根据二氧化硫和水反应的方程式判断溶液中存在的微粒,注意二氧化硫和水的反应是可逆反应;
(3)根据盐类的性质分析,强碱弱酸盐亚硫酸钠和亚硫酸氢钠都能发生水解生成亚硫酸,据此判断正误;
(4)亚硫酸钠和亚硫酸氢钠都是强碱弱酸盐,都能发生水解,但亚硫酸钠的水解程度大于亚硫酸氢钠的水解程度.
点评:本题考查了探究二氧化硫漂白性的实验,明确各物质的性质是解本题关键,注意采用对比方法进行分析,难度较大,根据物质的性质设计实验是学习的难点,也是高考的热点.
故答案为:酒精的品红溶液中不含水,二氧化硫直接和品红反应;
(2)该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥;二氧化硫有毒,所以多余气体不能直接排空,故要有尾气处理装置,
二氧化硫和水反应生成亚硫酸,SO2+H2O?H2SO3,亚硫酸是二元弱酸,所以能发生两步电离,第一步生成氢离子和亚硫酸氢根离子,亚硫酸氢根离子电离生成亚硫酸根离子和氢离子,H2SO3?H++HSO3-,HSO3-?H++SO32-,以上反应都是可逆反应,所以存在的含有硫元素的微粒有(除二氧化硫外)H2SO3、HSO3-、SO3 2-,
故答案为:①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);②没有尾气吸收装置;H2SO3;
(3)亚硫酸钠和亚硫酸氢钠都是强碱弱酸盐,都能发生水解,水解反应方程式为:亚硫酸钠的水解:SO32-+H2O=HSO3-+OH-、HSO3-+H2O=H2SO3+OH-;亚硫酸氢钠的水解,HSO3-+H2O=H2SO3+OH-,通过水解方程式看出,无论亚硫酸钠还是亚硫酸氢钠都能水解生成亚硫酸,故该说法错误,
故答案为:否;因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸;
(4)Na2SO3和NaHSO3都能电离和水解,但水解是微弱的,电离程度大于水解程度;HSO3-能电离出SO32-,但较弱,则Na2SO3溶液中的SO32-比NaHSO3溶液中的大,Na2SO3使酒精品红溶液褪色快,说明起漂白作用的是SO32-,
故答案为:使品红褪色的微粒是SO32-;SO32-离子浓度大,褪色快,而SO32-浓度小时,褪色慢.
分析:(1)根据酒精品红溶液中的成分判断哪种物质和品红反应;
(2)根据实验目的及二氧化硫的性质分析,应制取干燥的二氧化硫气体;二氧化硫有毒,应有尾气处理装置;
根据二氧化硫和水反应的方程式判断溶液中存在的微粒,注意二氧化硫和水的反应是可逆反应;
(3)根据盐类的性质分析,强碱弱酸盐亚硫酸钠和亚硫酸氢钠都能发生水解生成亚硫酸,据此判断正误;
(4)亚硫酸钠和亚硫酸氢钠都是强碱弱酸盐,都能发生水解,但亚硫酸钠的水解程度大于亚硫酸氢钠的水解程度.
点评:本题考查了探究二氧化硫漂白性的实验,明确各物质的性质是解本题关键,注意采用对比方法进行分析,难度较大,根据物质的性质设计实验是学习的难点,也是高考的热点.

练习册系列答案
相关题目
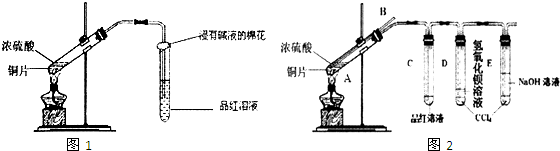
某研究性学习小组为探究Cu与浓H2SO4的反应及其产物SO2的性质,设计如图1实验装置:
(1)写出铜与浓硫酸反应的化学方程式: ;浸有碱液的棉花的作用是 .
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO2的性质,经过同学问的讨论和与老师的交流,设计了如图2实验装置.
①请写出长导管B的作用 (只写一点就可).
②对试管A中的浓H2SO4和铜片进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
请你应用类比研究方法帮他们预测D试管未出现浑浊的原因: .
③为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成下列实验内容:
(1)写出铜与浓硫酸反应的化学方程式:
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO2的性质,经过同学问的讨论和与老师的交流,设计了如图2实验装置.
①请写出长导管B的作用
②对试管A中的浓H2SO4和铜片进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
③为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成下列实验内容:
| 实验方案 | 现象 |
| 1.取少量溶液于试管中,加入稀盐酸,加热, 用湿润的蓝色石蕊试纸检验生成的气体. |
|
| 2.取少量溶液于试管中,加入 |

 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑