题目内容
【题目】向0.1molL-1的H2SO4溶液中滴入0.1molL-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
A.
B.
C.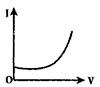
D.
【答案】A
【解析】溶液的导电能力与离子浓度成正比,离子浓度越大其溶液导电能力越大,硫酸是强电解质,在水溶液里完全电离,向硫酸溶液中滴加氢氧化钡溶液至过量,硫酸和氢氧化钡发生反应H2SO4+Ba(OH)2=BaSO4↓+2H2O,硫酸钡是难溶物,水是弱电解质,所以溶液中离子浓度逐渐减小,当氢氧化钡过量时,氢氧化钡是强电解质,在水溶液里完全电离,则溶液中离子浓度逐渐增大,所以溶液的导电能力将增大,则整个过程中,溶液导电能力是先减小后增大,A项正确;答案选A。
所以答案是:A

【题目】I.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是________________________________________。
(3)四种金属活泼性由强到弱的顺序是______________________。
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是________。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________。