题目内容
【题目】下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是___________,氧化性最强的单质是_______,用一个化学反应证明H单质的氧化性强于G单质____________________________。
(2)D的最高价氧化物与I的最高价氧化物对应的水化物反应的离子方程式为_____________。
(3)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为_______________。
(4)B、C、D、G、I离子半径由大到小的顺序是_______________________。
(5)用电子式表示化合物MgCl2的形成过程_________________________。
【答案】Ne F2 2F2+2H2O=4HF+O2 Al2O3+6H+=2Al3++3H2O HF>H2O>NH3 O2->F->Na+>Mg2+>Al3+ ![]()
【解析】
根据表格可知:A:H、B:Na、 C:Mg、D:Al、E:C、F:N、G:O、H:F、I:Cl、J:Ne,结合相关知识分析判断。
(1)其中H、C、N、O、F、Cl,Ne是非金属元素,根据同周期、同主族元素非金属性递变规律可知,非金属性最强的应该是F,即氧化性最强的单质是F2,F元素只有负价没有正价,化学性质最不活泼的应是惰性气体,即Ne,能证明F2的氧化性强于O2,可利用氧化剂的氧化性强于氧化产物氧化性来证明;
答案: Ne;F2;2F2+2H2O=4HF+O2;
(2)D的最高价氧化物是Al2O3、I的最高价氧化物对应的水化物是HClO4,反应的离子方程式为Al2O3+6H+=2Al3++3H2O;
答案:Al2O3+6H+=2Al3++3H2O;
(3)非金属性越强,气态氢化物越稳定;同一周期,从左到右非金属性增强。
答案: HF>H2O>NH3;
(4)半径比较:①电子层数越多,半径越大②电子层相同时,核电荷数越大,吸电子能力越强,半径越小;
答案:O2->F->Na+>Mg2+>Al3+;
(5)箭头左边写原子电子式,箭头右边写氯化镁电子式;
答案:![]() 。
。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
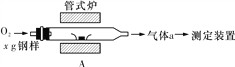
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
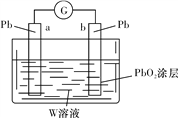
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝

