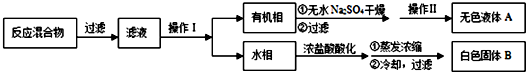
题目内容
11.对Na、Mg、Al的有关性质的叙述正确的是( )| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
分析 Na、Mg、Al位于周期表同一周期,从左到右,金属性逐渐增强,对应的单质的还原性逐渐减弱,粒子半径逐渐减小.
解答 解:A.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B.同周期原子半径从左到右逐渐减小,则原子半径:Na>Mg>Al,故B错误;
C.金属的原还性越强,对应离子的氧化性越弱,则Na+<Mg2+<Al3+,故C错误;
D.元素的金属性越强,对应离子的还原性越强,则单质的还原性:Al<Mg<Na,故D错误.
故选A.
点评 本题考查元素周期律的递变规律,题目难度不大,注意把握周期律的递变规律,注意粒子半径的大小比较.

练习册系列答案
相关题目
2.X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是( )
| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成 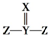 分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
6.已知钫(Fr) 和砹(At)分别是碱金属元素和卤族元素中原子序数最大的元素,关于两者性质的预测,不正确的是( )
| A. | 钫与水反应发生爆炸,生成的氢氧化物FrOH是一种极强的碱 | |
| B. | 钫极易在氧气中燃烧,燃烧生成复杂的氧化物 | |
| C. | 砹单质是有色气体,易溶于CCl4等有机溶剂 | |
| D. | 砹单质不容易与氢气化合 |
16.下列化合物电子式书写正确的是( )
| A. | 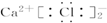 | B. |  | C. | 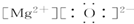 | D. |  |
3.以下实验或操作不能达到目的是( )
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
20.冶铁的原料为铁矿石、焦炭、空气和石灰石.测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素).若每生产1000kg生铁排放煤气2400m3,则至少需要补充空气?(空气体积分数:氮气0.8 氧气0.2),气体都在同温同压下测定.( )
| A. | 1392m3 | B. | 1740m3 | C. | 1920m3 | D. | 2304m3 |
1.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列说法中,正确的是( )
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
 ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓. (或
(或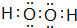 ),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)