题目内容
(8分)现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
(1) ④>②>③>①。(2) T℃ > a:b =101 : 9 。
(3) 产生白色沉淀同时产生无色气体 ;Al3+ +3HCO3— ==3CO2↑ +Al(OH)3↓
(3) 产生白色沉淀同时产生无色气体 ;Al3+ +3HCO3— ==3CO2↑ +Al(OH)3↓
(1)酸或碱中的氢离子或OH-浓度越大,对水的抑制越大,氯化铵水解促进水的电离,所以①②③④四种溶液中由水电离出的H+浓度由大到小的顺序应该是④>②>③>①。
(2)电离吸热,加热促进水的电离,氢离子浓度最大,所以T℃>25℃。所得溶液的pH = 10,则氢氧化钠是过量的,反应后溶液中氢离子浓度10-10mol/L,则OH-浓度是10-13÷10-10=0.001mol/L,则有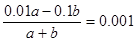 ,解得a:b =101 : 9。
,解得a:b =101 : 9。
(3)硫酸铝水解显酸性,碳酸氢钠水解显碱性,所以二者混合后水解相互促进,生成氢氧化铝沉淀和CO2气体,方程式为Al3+ +3HCO3— ==3CO2↑ +Al(OH)3↓。
(2)电离吸热,加热促进水的电离,氢离子浓度最大,所以T℃>25℃。所得溶液的pH = 10,则氢氧化钠是过量的,反应后溶液中氢离子浓度10-10mol/L,则OH-浓度是10-13÷10-10=0.001mol/L,则有
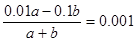 ,解得a:b =101 : 9。
,解得a:b =101 : 9。(3)硫酸铝水解显酸性,碳酸氢钠水解显碱性,所以二者混合后水解相互促进,生成氢氧化铝沉淀和CO2气体,方程式为Al3+ +3HCO3— ==3CO2↑ +Al(OH)3↓。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
 的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( ) 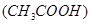 减小,电离平衡向生成醋酸分子的方向移动?
减小,电离平衡向生成醋酸分子的方向移动?  也增大了
也增大了 H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。 约为___ _%。
约为___ _%。 = Ka(HF)
= Ka(HF)