题目内容
【题目】【加试题】(10分)碳、硫和氮元素及其化合物的处理是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
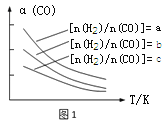
若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)SO2的水溶液呈酸性,某温度下,0.02 molL﹣1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g) + O2(g) 2SO3(g) △H1;
反应2:2NO(g) + O2(g) 2NO2(g) △H2;
反应3:SO2(g) + NO2(g) SO3(g) + NO(g) △H3;
若△H1<△H2<0,则反应3属于 (填“放热”或“吸热”)反应。
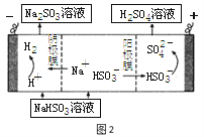
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图如图2。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g) + NO2(g) SO3(g) + NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在图3画出正反应速率v正在10至30min间随时间变化的曲线图。
【答案】(1)减小(1分) (2)0.01(2分)
(3)放热(1分) (4)HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+(2分)
(5)=(2分) 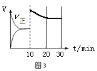 (2分)
(2分)
【解析】
试题分析:(1)根据图1可以看出,对于反应2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g),在相同投料比[n(H2)/n(CO)]时,温度升高,CO的平衡转化率降低,说明平衡逆向移动,即升高温度,平衡左移,平衡常数减小。
CH3OCH3(g) + H2O(g),在相同投料比[n(H2)/n(CO)]时,温度升高,CO的平衡转化率降低,说明平衡逆向移动,即升高温度,平衡左移,平衡常数减小。
(2)由于0.02molL-1亚硫酸水溶液的pH等于2,即溶液中的氢离子浓度为0.01mol/L,而c(HSO3-)=c(H+),列三段式:H2SO3 HSO3- + H+
初始浓度mol/L 0.02 0 0
转化浓度mol/L 0.01 0.01 0.01
平衡浓度mol/L 0.01 0.01 0.01
电离平衡常数Ka1=0.01mol/L×0.01mol/L÷0.01mol/L=0.01。
(3)已知反应1:2SO2(g) + O2(g) 2SO3(g) △H1;;反应2NO(g) + O2(g) 2NO2(g) △H2,根据盖斯定律,将①/2-②/2可得目标反应:SO2(g)+NO2(g)SO3(g)+NO(g),则△H3=(△H1-△H2)÷2,由于△H1<△H2<0,△H3=(△H1-△H2)÷2<0,此反应放热。
(4)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-失去电子被氧化生成SO42-,阳极电极反应式是HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g) + NO2(g) SO3(g) + NO(g) △H3,当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,而由于SO2(g)+NO2(g)SO3(g)+NO(g)是气体的物质的量不变的反应,平衡不移动,则两次平衡时NO2的转化率α1=α2;由于10min时再通入各1mol的SO2和NO2,反应物的浓度立即增大,则正反应速率v正立即增大,后逐渐减小,最后20min达到平衡,正反应速率v正在10至30min间随时间变化的曲线图为 。
。
