��Ŀ����
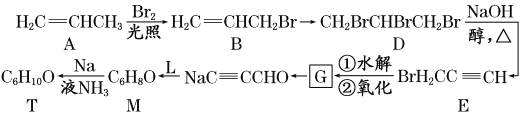
����Ŀ����18�֣��ӱ������еõ�һ����A��C10H16��������������������A��ط�Ӧ���£�
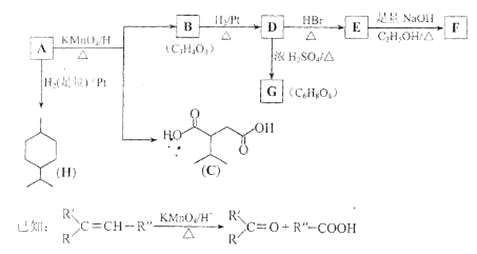
��1��H�ķ���ʽΪ ��
��2��B���������ŵ�����Ϊ ��
��3����������COOCH3���ŵ�C��ͬ���칹�干�� �֣������������칹�������к˴Ź������׳���2�����շ���칹��ṹ��ʽΪ ��
��4��B��D��D��E�ķ�Ӧ���ͷֱ�Ϊ �� ��
��5��GΪ����Ԫ���Ļ����д����ṹ��ʽ�� ��
��6��F��һ�������·����ۺϷ�Ӧ�ɵõ�һ�ָ���ˮ����֬������֬����Ϊ ��
��7��д��E��F�Ļ�ѧ����ʽ�� ��
��8��A�Ľṹ��ʽΪ ��A������ʵ�����Br2���мӳɷ�Ӧ�IJ��ﹲ�� �֣������������칹����
���𰸡���1��C10H20
��2���ʻ� �Ȼ�
��3��4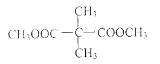
��4���ӳɷ�Ӧ����ԭ��Ӧ�� ȡ����Ӧ
��5��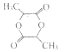
��6���۱�ϩ����
��7��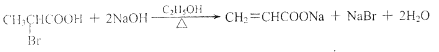
��8��![]() ��3
��3
��������
���⣨1������H�Ľṹ��ʽ�ɵ÷���ʽΪC10H20
��2��B�Ľṹ��ʽΪCH3![]() COOH������B���������ŵ�����Ϊ�ʻ� �Ȼ�
COOH������B���������ŵ�����Ϊ�ʻ� �Ȼ�
��3����������COOCH3���ŵ�C��ͬ���칹 ��CH3OOCCH2CH2CH2COOCH3��CH3OOCCH2CH(CH3)COOCH3��CH3CH2C(COOCH3)2��4�֣��˴Ź������׳���2�����շ壬��Hԭ�ӵ�λ����2�֣��ṹ��ʽΪ��
��CH3OOCCH2CH2CH2COOCH3��CH3OOCCH2CH(CH3)COOCH3��CH3CH2C(COOCH3)2��4�֣��˴Ź������׳���2�����շ壬��Hԭ�ӵ�λ����2�֣��ṹ��ʽΪ��
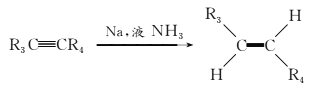
��4��B��DΪ�ʻ���H2�����ļӳɷ�Ӧ��D��EΪD�е���-Hԭ�ӱ�Brȡ������Ӧ����Ϊȡ����Ӧ��
��5��D�������Ȼ����ǻ�����������Ӧ����G����G�Ľṹ��ʽΪ��
��6��EΪ��ϩ�ᣬ��NaOH����Һ��Ӧ���ɱ�ϩ���ƣ��Ӿ۷�Ӧ�ɵ�F������Ϊ���۱����ơ�
��7��E��NaOH����Һ������ȥ��Ӧ���кͷ�Ӧ������E��F�Ļ�ѧ����ʽΪ��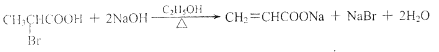
��8������B��C�Ľṹ��ʽ��A�ķ���ʽ C10H16���Ƴ�A�Ľṹ��ʽΪ��![]() ��A������̼̼˫��������ʵ�����Br2�ɷֱ���н��мӳɷ�Ӧ��Ҳ���Է���1,4�ӳɣ����Բ��ﹲ��3�֡�
��A������̼̼˫��������ʵ�����Br2�ɷֱ���н��мӳɷ�Ӧ��Ҳ���Է���1,4�ӳɣ����Բ��ﹲ��3�֡�

 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�����Ŀ�����Ȼ���ͭ��CuCl��������ˮ���������������������ռ������ȼ��ȡ�
��1����һ��������CuSO4��NaCl��Һ�г�������һ��Ũ�ȵ�Na2SO3��Һ���Ƶ�CuCl�������Na2SO3��Һ�������ҺpH��ϵ��ͼ��ʾ��

�� 0 ~ 600 mLʱpH���͵�ԭ����_______�������ӷ���ʽ��ʾ����
�� 600 ~ 2000 mL�Ĺ������д̼�����ζ�������������������__________��
��2��CuCl����һ���Ʊ�ԭ����Cu2++Cu+2Cl����2CuCl K��5.85��106����0.01 molL��1��CuCl2��Һ�м���������ͭ��д���������˵���ܷ�����CuCl�� ________��
��3��ʹ��CuCl��CO����ķ�ӦΪCuCl(s) + xCO(g) ![]() CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
A�������¶� B������ѹǿ
C���ӳ���Ӧʱ�� D����CuCl��ɢ�����ɶ�ķ���ɸ��
���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH���±�:
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
��������Һ�е������ӣ����������������ǿ����__________ �����ݱ������ݣ��������������Һ�ֱ�ϡ��100����pH�仯�����ǣ�����ţ�___________
A�� HClO B��H2CO3 C�� CH3COOH
��2������������һ�� ______������ǿ����������������ʡ�ijС��ͬѧ̽������NaClO��KAl(SO4)2��Һ��Ϸ�Ӧ��ʵ�顣��������ƿ�е�NaClO���뱥��KAl(SO4)2��Һ�����������İ�ɫ��״�������������������ԭ����______�����÷�Ӧ�����ӷ���ʽ��ʾ����
��3��ʵ�����г�����������������ϴ�����ᴿ��
��150mL 1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��_________��