题目内容
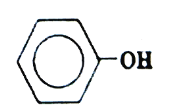
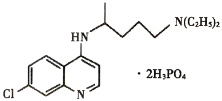
【题目】磷酸氯喹(结构如图所示)在细胞水平上能有效抑制新型冠状病毒的感染,我国印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确规定了其用量。
(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有________种,基态锗原子的最外层的电子排布图为__________________。
(2)C、N、O三种元素第一电离能由大到小的顺序是_____________________。
(3)磷酸氯喹分子中氮原子的杂化方式为________,苯环中含有的共价键类型是________。
(4)![]() 的空间构型是____________,与
的空间构型是____________,与![]() 互为等电子体的分子是____________(写一种即可)。
互为等电子体的分子是____________(写一种即可)。
(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是________________。
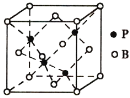
(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是___________,设阿伏加德罗常数的值为NA,则BP晶体的密度是___________g/cm3(列出计算表达式)。
【答案】8 ![]() N>O>C sp2、sp3 σ键和π键 正四面体形 CCl4(或SiCl4、SiF4等) H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子
N>O>C sp2、sp3 σ键和π键 正四面体形 CCl4(或SiCl4、SiF4等) H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子 ![]()
![]()
【解析】
(1)硅原子有14个电子,硅原子核外电子排布式为1s22s22p63s23p2,基态锗原子的最外层的电子排布式为4s24p2。
(2)同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
(3)分别分析磷酸氯喹分子中氮的价层电子对数判断杂化方式,苯环中碳原子采取sp2杂化,存在σ键和π键。
(4)计算PO43的价层电子对数,根据价电子数F+= O,C = Si = P+分析等电子体。
(5)溶解性有相似相溶和氢键的影响。
(6)晶体中B原子与P原子的最近距离是体对角线的四分之一,先分析晶胞中B原子和P原子个数,再求BP晶体的密度。
⑴硅原子有14个电子,硅原子核外电子排布式为1s22s22p63s23p2,则基态硅原子核外电子的空间运动状态有8种,基态锗原子的最外层的电子排布式为4s24p2,最外层电子排布图为![]() ;故答案为:8;
;故答案为:8;![]() 。
。
⑵同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此C、N、O三种元素第一电离能由大到小的顺序是N>O>C;故答案为:N>O>C。
⑶磷酸氯喹分子中 ,标示“2”的氮原子有3个σ键,1对孤对电子,价层电子对数为4,其N的杂化方式为sp3,标示“1”的氮原子有2个σ键,1对孤对电子,价层电子对数为3,其N的杂化方式为sp2,苯环中碳原子采取sp2杂化,存在σ键和π键;故答案为:sp2、sp3;σ键和π键。
,标示“2”的氮原子有3个σ键,1对孤对电子,价层电子对数为4,其N的杂化方式为sp3,标示“1”的氮原子有2个σ键,1对孤对电子,价层电子对数为3,其N的杂化方式为sp2,苯环中碳原子采取sp2杂化,存在σ键和π键;故答案为:sp2、sp3;σ键和π键。
⑷PO43的价层电子对数![]() ,其空间构型是正四面体形,由于F+= O,C = Si = P+,因此与PO43互为等电子体的分子是CCl4(或SiCl4、SiF4等);故答案为:正四面体形;CCl4(或SiCl4、SiF4等)。
,其空间构型是正四面体形,由于F+= O,C = Si = P+,因此与PO43互为等电子体的分子是CCl4(或SiCl4、SiF4等);故答案为:正四面体形;CCl4(或SiCl4、SiF4等)。
⑸由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是H2O与C2H5OH均为极性分子,相似相溶原理,H2O与C2H5OH分子之间能形成氢键;故答案为:H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子。
⑹已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是体对角线的四分之一即![]() ,根据分析得到晶胞中B原子个数为
,根据分析得到晶胞中B原子个数为![]() ,P原子个数为4,阿伏加德罗常数的值为NA,则BP晶体的密度是
,P原子个数为4,阿伏加德罗常数的值为NA,则BP晶体的密度是 ;故答案为:
;故答案为:![]() 。
。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |