题目内容
【题目】请写出下列物质的电子式:
(1)H2S________; (2)CO2________; (3)N2________;
(4)OH-________; (5)HClO________;(5)Na2O2________。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
【解析】
一般情况下,非金属元素的原子之间通过共用电子对(或共价键)结合,活泼的金属元素与非金属元素的原子间通过离子键结合,使物质微粒都达到相应的稳定结构,据此分析判断。
(1)S原子最外层有6个电子,其中的2个成单电子与2个H原子形成2对共用电子对,使分子中每个原子都达到稳定结构,电子式为:![]() ;
;
(2)CO2分子中C原子最外层有4个电子,O原子最外层有6个电子,C原子与2个O原子形成四对共用电子对,使分子中每个原子都达到最外层8个电子的稳定结构,电子式为:![]() ;
;
(3)N原子最外层有5个电子,N2分子中2个N原子形成3个共价键,使分子中每个N原子都达到最外层达到8个电子的稳定结构,电子式为:![]() ;
;
(4)OH-为阴离子,O原子与H原子形成1对共用电子对,O原子再获得1个电子,从而使OH-中O原子达到最外层8个电子稳定结构,H原子达到最外层2个电子的稳定结构,电子式为:![]() ;
;
(5)HClO为共价化合物,分子中O原子分别与H、Cl原子各形成1对共用电子对,使分子中每个原子都达到稳定结构,电子式为:![]() ;
;
(6)Na2O2为离子化合物,2个Na+与O22-通过离子键结合,O22-中的2个O原子通过共价单键结合,电子式为:![]() 。
。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______,______。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?__________。
(3)他们记录的实验数据如下:已知:![]()
①计算完成下表。(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 温度差平均值 | ||
t 1 | t 2 | ||||
1 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.3℃ | _____ |
2 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.5℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:______________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将________(填“变大”或“变小”或“无影响”)。
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
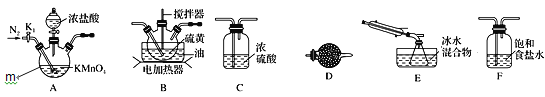
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
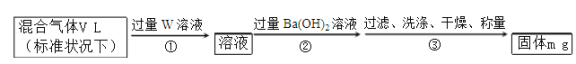
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。