题目内容
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol ,则CH4(g) +![]() O2(g) = CH3OH(g) △H=___。
O2(g) = CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0。
CH3OCH3(g) + H2O(g) △H<0。
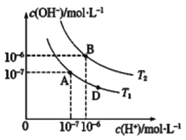
①.某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是___。
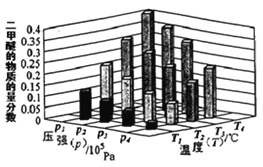
A. P1>P3, T1>T3 B. P3>P2,T3>T2 C.P2>P4,T4>T2 D.P1>P4,T2>T3
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.某反应物的体积百分含量增大
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2, 发生反应CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。
CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。

①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
【答案】-156kJ/mol AD B KA=KB>KC 2
【解析】
(1)根据盖斯定律进行分析;
(2)①.由反应方程式知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。
②根据影响化学平衡移动的外界因素及平衡移动原理、化学平衡状态的特征进行分析;
(3)①根据温度对化学平衡常数的影响进行分析。
② 根据两点温度相同则平衡常数相同进行计算。
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-784kJ/mol ①
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-628kJ/mol ②
O2(g)=CO2(g)+2H2O(l) △H=-628kJ/mol ②
①-②得:CH4(g) +![]() O2(g) = CH3OH(g) △H=-156kJ/mol。答案为:-156kJ/mol;
O2(g) = CH3OH(g) △H=-156kJ/mol。答案为:-156kJ/mol;
(2)①.由反应方程式2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0可知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。答案为:AD;
CH3OCH3(g) + H2O(g) △H<0可知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。答案为:AD;
②2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0
CH3OCH3(g) + H2O(g) △H<0
A.从反应方程式可以看出,若往平衡体系中充入H2,平衡正向移动,但氢气的转化率减小,A不合题意;
B.逆反应速率先增大后减小,则可能是升高温度或往平衡体系中充入CH3OCH3或H2O(g),平衡逆向移动,B符合题意;
C.化学平衡常数K值增大,只能为降低温度,平衡正向移动,C不合题意;
D.某反应物的体积百分含量增大,可能是往平衡体系中加入该反应物,则平衡正向移动,D不合题意。答案为:B;
(3)①从图中可以看出,升高温度,CO的转化率减小,则平衡逆向移动,△H<0。在A、B点,温度相同,对应的平衡常数KA=KB;A、C点,T1<T2,对应的平衡常数KA>KC,从而得出A、B、C三点对应的平衡常数KA、KB、KC的大小关系为KA=KB>KC。
② 在A点,容器体积为10L:

K=![]() ;
;
在B点,设气体的体积为V:
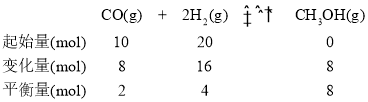
A和B两点的温度相同,则平衡常数相同,故K=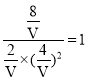 ,解之得,V=2L。答案为:2。
,解之得,V=2L。答案为:2。

【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:

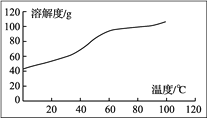
已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀 | 2.1 | 4.7 | 4.3 |
完全沉淀 | 3.2 | 6.7 | 5.6 |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。
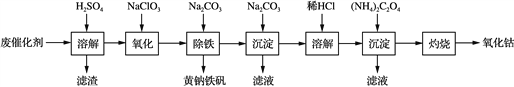
【题目】黄钾铁矾渣经如下流程可将其转化为锰锌铁氧体:

已知:①黄钾铁矾渣中铁主要以Fe2O3形式存在,锌主要以硫酸锌(ZnSO4)、氧化锌(ZnO)、硅酸锌(ZnSiO3)形式存在,黄钾铁矾渣的某些元素成分如下表所示:
元素 | Fe | Zn | Cu | Cd | Ca | Mg | Si |
质量分数 | 28.9 | 8.77 | 0.37 | 0.18 | 0.37 | 0.84 | 4.63 |
②NH4F溶液用于沉淀Mg2+和Ca2+,②Fe和Cd的金属活动性相近
⑴“酸浸”后,滤渣1的主要成分为________(写化学式);为了提高浸出率,可采取的措施有________(写出一种即可)。
⑵“还原除杂”工序中,加入铁粉是为了除去溶液中________、________等金属杂质离子。
⑶加入(NH4)2S沉淀Cd2+时应避免过量,原因是________;若此过程中溶液搅拌时间过长,则会导致Cd2+去除率偏低,原因是________。(已知:CdS的溶度积Ksp = 8×10-27,FeS的溶度积Ksp = 4×10-19,ZnS的溶度积Ksp = 1.6×10-24)
⑷写出“共沉淀”工序中生成FeCO3的离子反应方程式为:________。
⑸锰锌铁氧体是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:

①写出除锰(Mn2+)步骤中的离子方程式________。
②准确量取25.00 mL溶液A,掩蔽铁后,用二甲酚橙作指示剂,用0.0100mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+ (反应原理为Zn2+ + H2Y2- =ZnY 2- + 2H+),至滴定终点时消耗EDTA标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数为________。