题目内容
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为
| A.2:1 | B.4:1 | C.1:1 | D.3:1 |
A
解析试题分析:硅、铝与氢氧化钠反应生成氢气,铁不与氢氧化钠反应。铁、铝与稀硫酸反应生成氢气,硅不与硫酸反应,两过程生成的氢气相等。由于反应中Al都表现+3价,铝与氢氧化钠、硫酸反应生成的氢气相等,则铁与硫酸反应生成的氢气等于硅氢氧化钠反应生成的氢气,反应中铁表现+2价、硅表现+4价,根据电子转移守恒有:n(Fe)×2=n(Si)×4,解得n(Fe):n(Si)=2:1,答案选A。
考点:考查硅、铝、铁混合物与酸以及强碱反应的有关计算

练习册系列答案
相关题目
下列叙述正确确的是( )
A.48gO3和O2的混合气体中含有6.02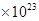 个分子 个分子 |
B.常温常压下,4.6gNO2气体含有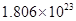 个原子 个原子 |
C.0.5mol 1LCuCl2溶液中含有 1LCuCl2溶液中含有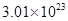 个Cu2+ 个Cu2+ |
D.标准状况下,3.36LH2O含有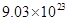 个分子H2O 个分子H2O |
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为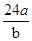 |
| B.1mol该氯原子的质量为aNAg |
C.mg该氯原子的物质的量为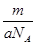 mol mol |
D.ng该氯原子所含的电子数为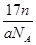 |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于 0.1NA |
| C.12 g金刚石中含有的共价键数为2NA |
| D.2.1 g DTO中所含中子数为NA |
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(烧碱)<n(稀硝酸)<n(盐酸) |
| B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) |
| D.n(盐酸)<n(稀硝酸)<n(烧碱) |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.3mol NF3与水完全反应生成HNO3和NO,转移电子数2NA |
| B.4.4g14CO2含中子数2.4 NA |
| C.标准状况下,2.24L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA |
| D.常温常压下,1.7g H2O2中含有的电子数为NA |
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A. (a+b) mol (a+b) mol | B.(a-b) mol | C. (a-b)mol (a-b)mol | D.(a+b) mol |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.0.1mol的2H35Cl含中子数为1.8NA |
| B.16g O3和O2混合物中氧原子数为NA |
| C.常温下,1L pH=l的溶液中H+的数目大于0.1NA |
| D.0.1 mol的H2O2中含有非极性键数为0.2NA |
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是
| A.Mg和Al | B.Al和Fe |
| C.Fe和Zn | D.Zn和Cu |