题目内容
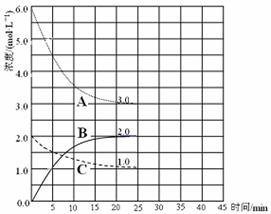
在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L求:
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
0.25 C(HI)=0.008mol·L-1
试题分析:(1)依题意可知,平衡时[H2]=[I2]=0.0080mol/L,
H2(g) + I2(g)
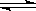 2HI(g)
2HI(g) 起始时各物质的浓度(mol·L-1) 0.010 0.010 0
各物质的浓度变化量(mol·L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol·L-1) 0.0080 0.0080 0.0040
根据平衡常数的概念可得K= C(HI)2/C(H2)C(I2)="(0.0040" mol·L-1)2/(0.0080 mol·L-1)2=0.25 ( 4分)
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L
H2(g) + I2(g)
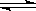 2HI(g)
2HI(g) 起始时各物质的浓度(mol·L-1) 0.02 0.02 0
各物质的浓度变化量(mol·L-1) x x 2x
平衡时各物质的浓度(mol·L-1) 0.02-x 0.02-x 2x
K=C(HI)2/C(H2)C(I2)=(2x)2/[(0.02-x)×(0.02-x)]="0.25"
解得:x="0.004" mol/L;
故平衡时C(HI)=0.008mol·L-1。 (4分)

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是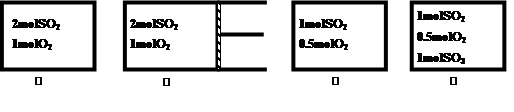
 PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是 Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是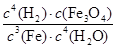
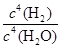
 2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
 N2O4(g)△H<0
N2O4(g)△H<0 2O3(g)△H>0
2O3(g)△H>0 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1