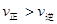题目内容
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是

 2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
B
试题分析:A、容器②相当于①容器达到平衡状态后再加压,而加压时平衡向右移动,反应物转化率增大,放出的热量更多,即Q2>Q1,故A错误;B、当③容器容积①容器容积一半大小时,两容器可建立等效平衡,此时①放热等于③放热的2倍,再将③容积扩大2倍以满足题中条件时,平衡逆向移动,反应物转化率降低,放热减少,即Q1>2Q3,故B正确;C、①和④两容器的平衡状态是等效平衡,但起始状态不同,所以放热不相等,故C错误;D、④相当于在③达到平衡后,再加入1molSO3,而增大SO3的浓度平衡逆向移动,放热必然减少,即Q3>Q4,故D错误。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是 3R(g)+S(l),说明该反应已达到平衡的是
3R(g)+S(l),说明该反应已达到平衡的是 2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )  xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指

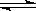 I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
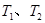 ,反应的平衡常数分别为K1、K2,则K1>K2
,反应的平衡常数分别为K1、K2,则K1>K2