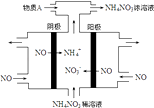
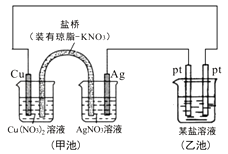
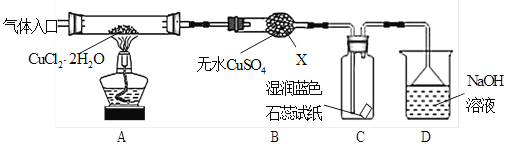
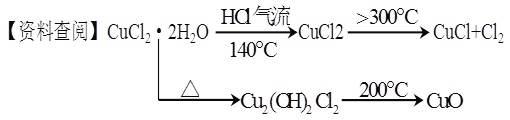题目内容
【题目】已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( ) 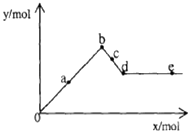
A.a﹣b时沉淀的物质的量:Al(OH)3比BaSO4多
B.b﹣c时溶液中离子的物质的量:AlO2﹣比Ba2+多
C.a﹣d时沉淀的物质的量:Al(OH)3一定小于BaSO4
D.d﹣e时溶液中离子的物质的量:Ba2+可能等于AlO2﹣
【答案】A
【解析】解:A、在b点时发生反应A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,沉淀的物质的量为Al(OH)3<BaSO4 , 故A错误;B、b点是沉淀的最大值,b~d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2 , b~c可以看成是发生反应2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O,所以离子的物质的量AlO2﹣>Ba2+ , 故B正确;
C、假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42﹣ , 向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH﹣=Al(OH)3↓、SO42﹣+Ba2+=BaSO4↓,则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42﹣全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量,故C正确;
D、d~e段中,某点时当加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与AlO2﹣的量相等,故D正确;
故选A.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目