题目内容
(6分)由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池生成氢气_______L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________kJ的热量。
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为__________g。
(1)2.24(2)28.58(3)12.9
解析试题分析:(1)Zn—Cu—H2SO4组成的原电池电池反应为:Zn+H2SO4=ZnSO4+H2 ↑,参加反应的锌的物质的量与生成氢气的物质的量相等,即n(H2)="n(Zn)=" 6.5g/65g/mol=0.1mol,标准状况下的体积为2.24L;(2)根据题意知,1mol氢气完全燃烧放出285.8kJ的热量,则0.1mol氢气完全燃烧放出28.58kJ;(3)当电解质溶液改为硫酸铜溶液时,电池反应为:Zn+CuSO4=ZnSO4+Cu,参加反应的锌的物质的量与生成铜的物质的量相等,即n(Zn)="n(Cu)=" 6.5g/65g/mol=0.1mol,析出铜的质量为6.4g,两个电极的差为减少的锌的质量与析出铜质量的和,两个电极的质量差=6.5g+6.4g=12.9g。
考点:考查原电池原理及相关计算。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。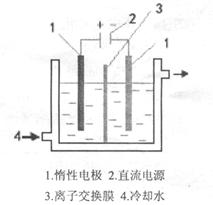
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 | 现象及结论 |
| | |
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
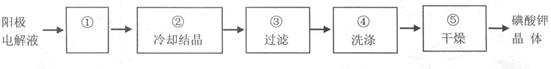
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
下列物质中,属于天然有机高分子化合物的是
| A.葡萄糖 | B.蔗糖 | C.淀粉 | D.油脂 |
正丁烷的二氯取代产物有几种
| A.3种 | B.4种 | C.5种 | D.6种 |



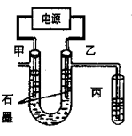
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: