题目内容
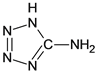
【题目】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________。
②上述配离子中含有的化学键类型有:__________________。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______;其中铜离子的配位数是_______。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______和______(填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________(写2种)。
【答案】 sp3 前者存在分子间氢键 a、b、c 氯化二乙二胺合铜(Ⅱ) 4 4s24p1 d区 0 N2 【答题空10】CN- (合理即给分) 正四面体 CO2、NCl3、CCl4、CO(任写2个)
【解析】(1)①乙二胺中N原子形成3个σ键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化;乙二胺分子间存在氢键,含有分子间氢键的沸点较高,所以乙二胺沸点高于Cl-CH2CH2-Cl;故答案为:sp3;前者分子间存在氢键;
②Cu2+离子与N原子之间形成配位键,乙二胺中N原子与H原子之间、N原子与C原子之间形成极性键,碳原子之间形成非极性键,所以存在配位键、极性键、非极性;故答案为:a、b、c;
③已知 中含有的氨基、乙基,铜离子为+2价,则配合物[Cu(en)2]Cl2的系统命名为氯化二乙二胺合铜(II);由图可知铜离子形成4个配位键,铜离子的配位数是4,故答案为:氯化二乙二胺合铜(II);4;
中含有的氨基、乙基,铜离子为+2价,则配合物[Cu(en)2]Cl2的系统命名为氯化二乙二胺合铜(II);由图可知铜离子形成4个配位键,铜离子的配位数是4,故答案为:氯化二乙二胺合铜(II);4;
(2)①Ga是第四横行第十一纵行的元素,所以是第四周期第IIIA族的元素,最外层电子排布式为4s24p1,故答案为:4s24p1;
②Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,最后排入的是3d电子,因此属于d区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中CO为电中性,则铁的化合价为0价; CO的等电子体必须是双原子分子或离子,且电子总数相等。CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2;如果是阳离子离子或阴离子,原子序数之和减去或加上所带电荷数值=14,所以有CN-,故答案为:d区;0价;N2; CN-;
③根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=1/2(a-xb)=1/2(8-4×2)=0,所以价层电子对数=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,分子中每个原子最外层都达到8电子稳定结构的判断公式是:化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构,否则就没有达到8电子稳定结构。所以两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2、NCl3、CCl4、CO,故答案为:正四面体;CO2、NCl3、CCl4、CO(任写2个)。

【题目】下列有关反应热的叙述中正确的是( )
①下表数据可以计算出 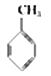 (g)+3H2(g)→
(g)+3H2(g)→ 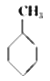 (g)的反应热;
(g)的反应热;
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1, 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A. ①②③④ B. ③④⑤ C. ④⑤ D. ⑥