题目内容
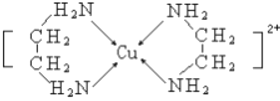
【题目】在5-氨基四唑(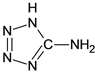 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为__________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为__________;在1mol 5-氨基四唑中含有的σ键的数目为__________.
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为__________.
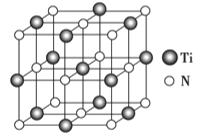
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化 钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为__________.
③[Ti(OH)2(H2O)4]2+中的化学键有__________.
a.σ键 b.π键 c.离子键 d.配位键.
【答案】1s22s22p63s23p63d104s24p1或[Ar] 3d104s24p1N>C>H9NA直线形Ti4CN3ad
【解析】
(1)Ga属于31号元素,第四周期第IIIA族元素,电子排布式为:1s22s22p63s23p63d104s24p1或[Ar] 3d104s24p1;(2)电负性越大,非金属性越强,同周期从左向右电负性增大,因此电负性的顺序是N>C>H,成键原子之间只能形成一个σ键,因此1mol该物质中含有σ键数目是9NA;(3)①N3-与CO2互为等电子体,CO2为直线形,因此N3-的空间构型为直线形;②Ti位于棱上和体心,Ti的个数为12×1/4+1=4,C位于顶点,个数为8×1/8=1,N位于面心,个数为6×1/2=3,因此化学式为Ti4CN3;③Ti4+与OH-、H2O之间存在配位键,OH-、H2O中存在共价键,或σ键故选项ad正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。
【题目】如表列出了①~⑥六种元素在元素周期表中的位置.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是 (填写元素符号);
(2)元素①③⑥的氢化物的分子式分别是 ; ; .
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是 .
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
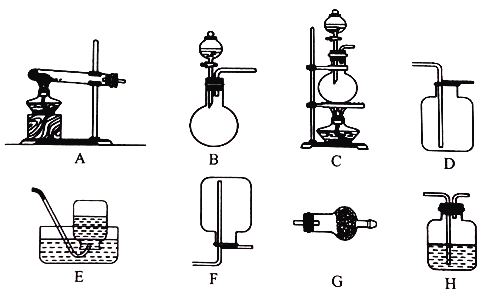
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |