题目内容
【题目】A、B、C、D、E五种短周期元素,B、C、D的原子序数依次递增。A原子核内有一个质子,B原子的电子总数与D原子最外层电子数相等,D原子最外层电子数是其电子层数的3倍,E原子的L层电子数小于K、M层电子数之和,由此推断:
(1)A与D组成的化合物中,含有非极性键的分子的电子式为________;B与D组成的三原子分子的结构式为__________;A与C组成的化合物分子的电子式为______________。
(2) C、D、E离子半径由大到小的顺序是______________________(填化学符号)
(3)E元素最高价氧化物对应水化物与氢氧化铝反应的离子方程式为__________________。
(4)已知A、B、C、D可组成一种化合物,其原子个数比为8︰1︰2︰3,该化合物的化学式为__________,属__________(离子、共价)化合物。
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________。
【答案】 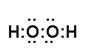 O=C=O
O=C=O ![]() Cl->N3->O2- 3H+ + Al(OH)3 = Al3++3H2O (NH4)2CO3 离子 NaNO2
Cl->N3->O2- 3H+ + Al(OH)3 = Al3++3H2O (NH4)2CO3 离子 NaNO2
【解析】(1)A与D组成的化合物中,含有非极性键的分子是双氧水,电子式为![]() ;B与D组成的三原子分子是CO2,结构式为O=C=O;A与C组成的化合物分子是氨气,含有极性键的共价化合物,电子式为
;B与D组成的三原子分子是CO2,结构式为O=C=O;A与C组成的化合物分子是氨气,含有极性键的共价化合物,电子式为![]() 。(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则C、D、E离子半径由大到小的顺序是Cl->N3->O2-。(3)Cl元素最高价氧化物对应水化物高氯酸与氢氧化铝反应的离子方程式为3H+ + Al(OH)3=Al3++3H2O。(4)已知A、B、C、D可组成一种化合物,其原子个数比为8︰1︰2︰3,该化合物的化学式为(NH4)2CO3,含有离子键,属离子化合物。(5)C有多种氧化物,其中甲的相对分子质量最小,应该是NO。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则根据电子得失守恒可知NO得到的电子数是
。(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则C、D、E离子半径由大到小的顺序是Cl->N3->O2-。(3)Cl元素最高价氧化物对应水化物高氯酸与氢氧化铝反应的离子方程式为3H+ + Al(OH)3=Al3++3H2O。(4)已知A、B、C、D可组成一种化合物,其原子个数比为8︰1︰2︰3,该化合物的化学式为(NH4)2CO3,含有离子键,属离子化合物。(5)C有多种氧化物,其中甲的相对分子质量最小,应该是NO。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则根据电子得失守恒可知NO得到的电子数是![]() ,因此氮元素化合价从+2价升高到+3价,则该含氧酸盐的化学式是NaNO2。
,因此氮元素化合价从+2价升高到+3价,则该含氧酸盐的化学式是NaNO2。