题目内容
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
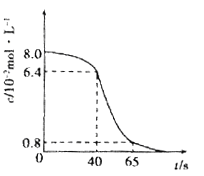
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。
① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
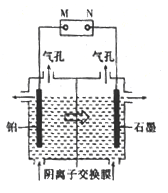
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
【答案】 5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O 1×10-3mol·L-1·s-1 Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大 溶液由绿色变为紫色,并有黑色固体生成 l 小于 pH过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 8.0 Mn2++2e-=Mn、2H++2e-=H2↑
【解析】(1)① 高锰酸钾与草酸发生氧化还原反应,生成锰离子、二氧化碳和水,反应的离子方程式为5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O,故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
② 前40秒KMnO4溶液的浓度变化了0.016mol/L,则草酸的浓度变化为1.6mol/L×![]() =0.04mol/L, v(草酸)=
=0.04mol/L, v(草酸)= ![]() =1×10-3mol·L-1·s-1,故答案为:1×10-3mol·L-1·s-1;
=1×10-3mol·L-1·s-1,故答案为:1×10-3mol·L-1·s-1;
③ 40s-65s的反应速率比前40s快,可能的原因是Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大,故答案为:Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大;
(2) ① 根据反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-,向MnO4-溶液中加入足量稀硫酸,氢氧根离子浓度减小,平衡正向移动,溶液由绿色变为紫色,并有黑色固体生成,故答案为:溶液由绿色变为紫色,并有黑色固体生成;
MnO2+2MnO4-+4OH-,向MnO4-溶液中加入足量稀硫酸,氢氧根离子浓度减小,平衡正向移动,溶液由绿色变为紫色,并有黑色固体生成,故答案为:溶液由绿色变为紫色,并有黑色固体生成;
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时,c(OH-)=1 mol/L K2MnO4的转化率为4/9,平衡时K2MnO4的浓度为0.512 mol/L×(1-![]() ),KMnO4的浓度为0.512 mol/L×
),KMnO4的浓度为0.512 mol/L×![]() ×
×![]() =0.512 mol/L×
=0.512 mol/L×![]() ,则该反应的平衡常数的值为
,则该反应的平衡常数的值为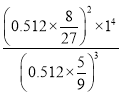 =1,故答案为:1;
=1,故答案为:1;
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,说明降低温度,平衡正向移动,则该反应的△H<0,故答案为:小于;
(3)加入稍过量的NH4HCO3能提高MnSO4的装化率,使MnCO3沉淀完全,溶液的pH不能过低,否则H+可与MnCO3,NH4HCO3反应,溶液的pH也不能过高,pH过高MnCO3会生成Mn(OH)2沉淀,故答案为:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解);根据MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13。Mn(OH)2开始沉淀的c(OH-)=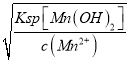 =
=![]() =10-6 mol/L,pH=8,因此使MnCOspan>3沉淀完全,而且不生成Mn(OH)2,溶液的pH 最高不能超过8,故答案为:pH过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 ; 8.0。
=10-6 mol/L,pH=8,因此使MnCOspan>3沉淀完全,而且不生成Mn(OH)2,溶液的pH 最高不能超过8,故答案为:pH过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 ; 8.0。
(4)电解池工作时,阴离子向阳极移动,阳离子向阴极移动,由阴离子移动方向可知石墨为阳极,铂极为阴极,阴极发生还原反应,生成锰的同时,氢离子得到电子被还原生成氢气,铂电极的电极反应式为Mn2++2e-=Mn、2H++2e-=H2↑,故答案为:Mn2++2e-=Mn、2H++2e-=H2↑。