��Ŀ����
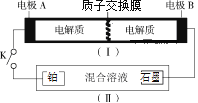
����Ŀ����ͼ(I)Ϊȫ����أ���ع���ԭ��Ϊ��2H+��VO2+��V2+![]() VO2+��V3++H2O��װ��(��)�еĵ��Һ�����ᡢ����Ļ��ˮ��Һ�����պϿ���Kʱ�����缫������NH2OH��������˵����ȷ���ǣ� ��
VO2+��V3++H2O��װ��(��)�еĵ��Һ�����ᡢ����Ļ��ˮ��Һ�����պϿ���Kʱ�����缫������NH2OH��������˵����ȷ���ǣ� ��
A.�պ�Kʱ��ȫ����ظ�����pH��������
B.�պ�Kʱ�����缫�ĵ缫��ӦʽΪ��NO3��+6e��+5H2O=NH2OH +7OH��
C.ȫ����س��ʱ���缫B�Ϸ�����ԭ��Ӧ
D.ȫ����طŵ�ʱ���缫B�Ϸ����ķ�ӦΪ��VO2++2H++e��=VO2++H2O
���𰸡�D
��������
��ع���ʱ�����ŵ�ʱ(I)װ��Ϊԭ��أ��ŵ�ʱ����Ӧ��V2+���ӱ��������缫AӦ�ǵ�Դ�ĸ�������������ʧ���ӵ�������Ӧ������ӦΪV2+-e-��V3+���缫BΪ������������Ӧ��VO2++2H++e-��VO2++H2O�����ʱ(I)װ��Ϊԭ��أ�(��)װ��Ϊ���أ����պϿ���Kʱ�����缫������NH2OH�缫Ϊ������ʯī�缫Ϊ���������ݴ˷������н��
A���ŵ�����У��ܷ�Ӧ���������ӣ���Һ��pH���Aѡ�����
B���պ�Kʱ�����缫Ϊ������������ԭ��Ӧ�������ҺΪ������Һ����������OH-���缫��ӦʽΪ��NO3��+6e��+7H+=NH2OH+2H2O����Bѡ�����
C�����ʱ���缫BΪ����������������Ӧ����Cѡ�����
D���ŵ�ʱ�缫BΪ������������Ӧ��VO2++2H++e-��VO2++H2O����Dѡ����ȷ��
�ʴ�ѡD��

����Ŀ���¶ȷֱ�ΪT1��T2ʱ��������X������Y��0.16mol����10L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g)��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
�¶�/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
����˵����ȷ���ǣ� ��
A. �÷�Ӧ������ӦΪ���ȷ�Ӧ
B. T2�¶��´˷�Ӧ��ƽ�ⳣ��K=4
C. �¶�ΪT1ʱ��0~t1ʱ��ε�ƽ��������(Z)=2.0��10��3mol��L��1��min��1
D. ��T1��ƽ����������������䣬�ٳ���0.2molZ��ƽ��ʱX�������������