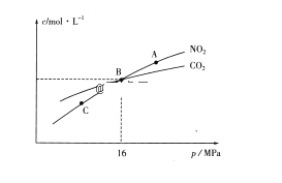
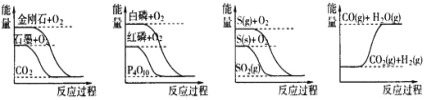
题目内容
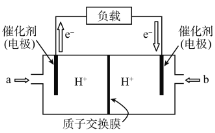
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
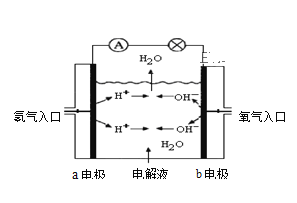
(1)下列叙述不正确的是 ______ 。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极 _________,b极 ____________;
(3)若电解质溶液为稀H2SO4,则电极反应式为:a极 __________,b极____________。
【答案】B 2H2-4e-+4OH-=4H2O O2+2H2O+4e-=4OH- 2H2-4e-=4H+ O2+4H++4e-=2H2O
【解析】
(1)在氢氧燃料电池中,氢气失电子发生氧化反应,通入氢气的电极是负极,氧气得电子发生还原反应,通入氧气的电极是正极;
(2)当电解质溶液是KOH时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;
(3)当电解质溶液是H2SO4时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水。
(1)A.在氢氧燃料电池中,H2失电子发生氧化反应,因此通入氢气的a极为电源的负极,A正确;
B.在氢氧燃料电池中,通入O2的b极为原电池的正极,正极上O2得电子发生还原反应,要结合电解质溶液的酸碱性来确定其电极反应式的书写,B错误;
C.氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,C正确;
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,D正确;
故合理选项是B;
(2)当电解质是碱溶液时,燃料氢气失电子生成的H+在碱性溶液中不能稳定存在,它和OH-反应生成H2O,所以负极上发生的电极反应式为2H2-4e-+4OH-=4H2O;正极上O2得电子和水生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;
(3)负极上失电子发生氧化反应,若电解质溶液是酸,则负极上氢气失电子后生成H+,其电极反应式为:2H2-4e-=4H+;正极上氧气得电子和氢离子反应生成水,发生还原反应,故其电极反应式为:O2+4H++4e-=2H2O。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案