题目内容
【题目】Ⅰ. 甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
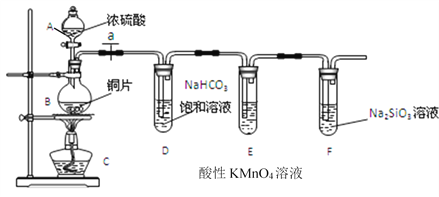
(1)填写所示仪器名称:A__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;
装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
Ⅱ.将等质量的锌片和铜片用导线相连并插入500 mL CuSO4溶液中构成如图所示的装置。

(1)该装置中能量主要的转化形式是__________,铜片周围溶液会出现________的现象。
(2)若锌2 min后的质量减少1.3 g,则导线中流过的电子为_______mol。
(3)若将装置的锌片换为石墨棒,电解质溶液换为FeCl3溶液,其正极反应为________。
【答案】 分液漏斗 检验装置气密性 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 除去二氧化硫气体 E试管中的溶液褪色不完全,F试管中出现白色沉淀 否 化学能转化为电能 溶液颜色变浅 0.04 Fe3++e-=Fe2+
CuSO4+SO2↑+2H2O 除去二氧化硫气体 E试管中的溶液褪色不完全,F试管中出现白色沉淀 否 化学能转化为电能 溶液颜色变浅 0.04 Fe3++e-=Fe2+
【解析】分析:Ⅰ.(1)根据装置图中的仪器分析;
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①根据铜与浓硫酸反应的生成物书写方程式;根据多余的二氧化硫会干扰后面的实验判断;
②根据二氧化碳与Na2SiO3溶液反应生成硅酸沉淀解答;
③依据最高价含氧酸的酸性强弱判断非金属性强弱;
Ⅱ.原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此解答。
详解:(1)根据装置图中的仪器可知A为分液漏斗;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏;
(3)①铜与浓硫酸反应生成硫酸铜、二氧化硫和水,则反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;二氧化硫也能与硅酸钠反应产生硅酸沉淀,因此多余的二氧化硫需要用酸性KMnO4溶液吸收,防止干扰后面的试验;
CuSO4+SO2↑+2H2O;二氧化硫也能与硅酸钠反应产生硅酸沉淀,因此多余的二氧化硫需要用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,但必须保证生成的二氧化碳中不存在二氧化硫,所以E试管中的溶液褪色不完全,F试管中出现白色沉淀即可说明碳元素的非金属性比硅元素非金属性强;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱;
Ⅱ.(1)该装置是原电池,其中能量主要的转化形式是化学能转化为电能;锌的金属性强于铜,锌是负极,铜是正极,溶液中的铜离子在正极放电析出铜,铜离子浓度减小,所以铜片周围溶液会出现溶液颜色变浅的现象。
(2)若锌2 min后的质量减少1.3 g,即参加反应的锌的物质的量是1.3g÷65g/mol=0.02mol,放电时锌失去2个电子,则导线中流过的电子为0.04mol。
(3)若将装置的锌片换为石墨棒,电解质溶液换为FeCl3溶液,此时铜电极是负极,石墨电极是正极,溶液中的铁离子放电,则其正极反应为Fe3++e-=Fe2+。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案